
【题目】![]() 使
使![]() 和
和![]() 通过灼热的炭层,生成HCl和
通过灼热的炭层,生成HCl和![]() ,当有
,当有![]() 参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
参与反应时释放出145kJ热量,写出该反应的热化学方程式________________.
![]() 火箭和导弹表面的薄层是耐高温物质
火箭和导弹表面的薄层是耐高温物质![]() 将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料
将石墨、铝粉和二氧化钛按一定比例混合在高温下煅烧,所得物质可作耐高温材料![]() ,则反应过程中,每转移1mol电子放出的热量为____________.
,则反应过程中,每转移1mol电子放出的热量为____________.
![]() 甲胺
甲胺![]() 是合成太阳能敏化剂的原料。工业合成甲胺原理:
是合成太阳能敏化剂的原料。工业合成甲胺原理:![]()
![]()
![]() 。
。
![]() 已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
已知键能指断开1mol气态键所吸收的能量或形成1mol气态键所释放的能量。几种化学键的键能如下表所示:
化学键 |
|
|
|
|
|
键能 | 413 | 351 | 463 | 393 | 293 |
则该合成反应的![]() ______________。
______________。
若![]() 的活化能为
的活化能为![]() ,由此计算
,由此计算![]()
![]() 的活化能
的活化能![]() ______。
______。
![]() 用
用![]() 将HCl转化为
将HCl转化为![]() ,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
,可提高效益,减少污染,传统上该转化通过如图所示的催化剂循环实现,
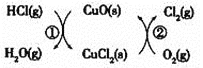
其中,反应![]() 为:
为:![]() 反应
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则总反应的热化学方程式为_____________,
,则总反应的热化学方程式为_____________,![]() 反应热用
反应热用![]() 和
和![]() 表示
表示![]() .
.
【答案】![]()
![]()
![]()
![]()
![]()
【解析】
根据题干信息及热化学方程式的含义书写相关反应的热化学方程式;根据热化学方程式及氧化还原反应中化合价的变化通过电子转移数目计算反应热;根据反应过程中化学键的变化,用已知的键能计算反应热及活化能;根据图示物质间的转化关系结合热化学方程式运用盖斯定律计算反应热,书写热化学方程式。
![]() 参与反应时释放出145KJ热量,则反应
参与反应时释放出145KJ热量,则反应![]() 会放出290KJ的能量,即
会放出290KJ的能量,即![]() ;
;
故答案为:![]() ;
;
![]() ,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ;
,转移12mol电子放热1176KJ,则反应过程中,每转移1mol电子放热98kJ;
故答案为:98kJ;
![]() ,反应热
,反应热![]() 正反应的活化能
正反应的活化能![]() 逆反应的活化能
逆反应的活化能![]() ,即
,即![]()
![]()
![]() ;
;
故答案为:![]()
![]() ;312
;312![]() ;
;
![]() 由图示可知,整个过程为:
由图示可知,整个过程为:![]() ,反应
,反应![]() 为:
为:![]() ,
,
反应![]() 生成
生成![]() 的反应热为
的反应热为![]() ,则反应热化学方程式为:
,则反应热化学方程式为:![]() ,
,
根据盖斯定律![]() 可得总反应的热化学方程式:
可得总反应的热化学方程式:![]() ,所以
,所以![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】将1 mL 0.10 mol/L 硫酸加水稀释成 2 L 溶液,则溶液中由水电离产生的H+ 的浓度为( )
A.1×10-10 mol/L
B.1×10-8 mol/L
C.1×10-11 mol/L
D.1×10-4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符合的是
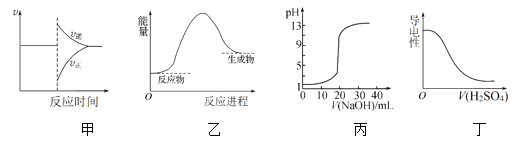
A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100mL Fe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示。忽略溶液体积的变化,下列说法正确的是( )

A.a点时溶液中阳离子仅为Cu2+和Fe2+
B.b点时溶液中发生的反应为:Fe+Cu2+=Cu+Fe2+
C.c点时加入的铁粉与Cu2+反应
D.原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①25℃、101kPa时,2C(s)+O2(g)=2CO(g) ΔH=221kJ·mol-1,②稀溶液中,H+(aq)+OH(aq)=H2O(l) ΔH=57.3kJ·mol-1。下列说法正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.①的反应热为221kJ·mol-1
C.浓硫酸与稀NaOH溶液反应生成1mol水放出的热量为57.3kJ
D.稀醋酸与稀NaOH溶液反应生成1mol水时放出57.3kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组在实验室用制备的氯气与一氧化氮在常温常压下合成亚硝酰氯。
【查阅资料】 亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃) 是一种黄色气体,液体状态呈红褐色,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。对眼睛、皮肤和粘膜有强烈刺激性,具有类似氯气和氮氧化物的毒作用。冰水中加入NaCl可降低温度。
【原料制备】 在实验室分别制备原料气NO和Cl2。
(1)用如下装置制备纯净干燥的气体,请补充下表中各仪器中的试剂。
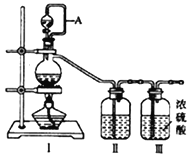
原料制备 | 装置Ⅰ | 装置Ⅰ | 装置Ⅱ |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①__________ | ②______ |
制备纯净NO | Cu | ③_______ | ④_________ |
【合成亚硝酰氯】 利用制得的NO和Cl2制备NOCl,装置如图所示:
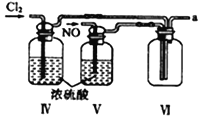
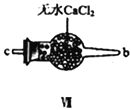
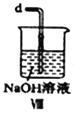
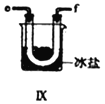
(2)装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是___________________。
(3)装置连顺序为 a→_______________(按气流自左向右方向,用小写字母表示)。
(4)装置Ⅴ的作用是___________________________________。
(5)装置Ⅸ在实验时,预期观察到的现象是__________________________________________。
(6)装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________________。
【拓展学习】
(7)查阅资料,得知配制王水(浓硝酸与浓盐酸的混酸) 时会生成亚硝酰氯和氯气,该反应的化学方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 表示阿伏伽德罗常数的值,下列说法正确的是
表示阿伏伽德罗常数的值,下列说法正确的是
A.标准状况下,2.24L三氯甲烷中含碳氯共价键的数目为0.3![]()
B.![]() 溶液与
溶液与![]() 溶液中的
溶液中的![]() 数目相同
数目相同
C.1mol硝基![]() 与46g二氧化氮
与46g二氧化氮![]() 中所含的电子数均为23
中所含的电子数均为23![]()
D.在一定条件下,![]() 和
和![]() ,充分反应,生成
,充分反应,生成![]() 的分子数为0.2
的分子数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是198 K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
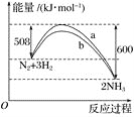
A.该反应的热化学方程式为N2+3H2![]() 2NH3ΔH=-92 kJ·mol-1
2NH3ΔH=-92 kJ·mol-1
B.a曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的反应热改变
D.升高温度,反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧10g乙炔生成二氧化碳和液态水放出热量500kJ,则下列热化学方程式书写正确的是( )
A.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=500kJ·mol-1
B.C2H2(g)+![]() O2(g)=2CO2(g)+H2O(g) ΔH=-1300kJ
O2(g)=2CO2(g)+H2O(g) ΔH=-1300kJ
C.2C2H2+5O2=4CO2+2H2O ΔH=-2600kJ
D.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com