
【题目】下列是元素周期表的一部分,A、B、C、D、E、F、G、X分别代表一种元素,其中X在周期表中的位置没有标出,请回答下列有关问题。

(1)X在A元素附近,与F能形成化学式为XF的离子化合物,X单质的密度小于水,有两种重要的氧化物。X在周期表中的位置是第______周期第______族;X单质与其相邻元素的单质形成的合金主要用途是_____________________。
(2)A、C具有相似的化学性质,请写出A和X的最高价氧化物对应的水化物之间反应的离子方程式______________________。
(3)B与水蒸气在高温下反应的化学方程式是_______________。
(4)E的一种氧化物通入F的水溶液中可以得到两种物质,写出反应的离子方程式:______________________________________________________。
(5)有同学判断G是一种稀有气体,由此判断不存在G的化合物。该说法是否正确:____________。
【答案】 三 ⅠA 原子反应堆的导热剂 Be(OH)2+2OH-===![]() +2H2O 3Fe+4H2O(g)
+2H2O 3Fe+4H2O(g)![]() Fe3O4+4H2 SO2+Cl2+2H2O===4H++2Cl-+
Fe3O4+4H2 SO2+Cl2+2H2O===4H++2Cl-+![]() 不正确
不正确
【解析】分析:首先根据元素在周期表中的相对位置判断出元素名称,然后结合元素周期律、相关物质的性质解答。
详解:根据元素A、B、C、D、E、F、G在周期表中的位置可知A是Be、B是Fe、C是Al、D是C、E是S、F是Cl、G是Xe。则
(1)X在Be元素附近,与Cl能形成化学式为XCl的离子化合物,X单质的密度小于水,有两种重要的氧化物,因此X是Na。Na的原子序数是11,在周期表中的位置是第三周期第ⅠA族;钠单质与其相邻元素的单质钾形成的合金主要用途是原子反应堆的导热剂。
(2)A、C具有相似的化学性质,则根据铝与氢氧化钠溶液反应的方程式可类推得到A和X的最高价氧化物对应的水化物之间反应的离子方程式为Be(OH)2+2OH-=BeO22-+2H2O。
(3)铁与水蒸气在高温下反应的化学方程式是3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(4)E的一种氧化物通入F的水溶液中可以得到两种物质,该氧化物是二氧化硫,与氯气反应的离子方程式为SO2+Cl2+2H2O=4H++2Cl-+SO42-。
(5)稀有气体元素也可以形成化合物,例如XeF2等,因此该说法是错误的。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值.下列说法正确的是( )
A.1 mol NO中含有的原子数目为2NA
B.常温下,22.4L氮气含有的原子数目为2NA
C.1L1 mol L﹣1 MgS04溶液中含有的Mg2+数目为2NA
D.2.8 g硅单质与足量氧气在高温下完全反应时,硅原子失去的电子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρgcm﹣1 , 质量分数为ω,其中含NH4+的物质的量为b moL.下列叙述中正确的是( )
A.溶质的质量分数为ω= ![]() ×100%
×100%
B.溶质的物质的量浓度c= ![]() mol?L﹣1
mol?L﹣1
C.溶液中c(OH﹣)= ![]() mol?L﹣1+c(H+)
mol?L﹣1+c(H+)
D.上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]()
![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质:粗盐 ![]()
![]()
![]()
![]()
![]()
![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+:试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 ![]()
![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中,正确的是
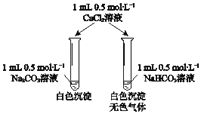
A. 实验前两溶液的pH相等 B. 实验前两溶液中离子种类完全相同
C. 加入CaCl2溶液后生成的沉淀一样多 D. 反应的离子方程式都是CO32-+Ca2+═CaCO3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体中心.试分析: 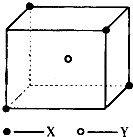
(1)晶体中每个Y同时吸引着个X,每个X同时吸引着个Y,该晶体的化学式为 .
(2)晶体中在每个X周围与它最接近且距离相等的X共有个.
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺流程如下所示:
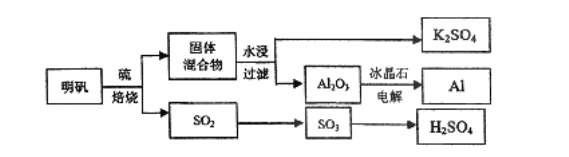
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是________,氧化剂与还原剂的物质的量之比为_________
(2)从水浸后的滤液中得到K2SO4晶体的方法是____;产物K2SO4中K元素的鉴定操作过程是____。
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应方程式为____。
(4)焙烧产生的SO2可用于制硫酸。已知25℃、l0lkPa时:
①2SO2(g)+O2(g) ![]() 2SO3(g) △H1=-197kJ·mol-1
2SO3(g) △H1=-197kJ·mol-1
②H2O(g)=H2O(l) △H2=-44kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=-545kJ·mol-1
则SO3(g)与H2O(1)反应的热化学方程式是__________________________。
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com