
����Ŀ������ʯ��������õ�����[KAl(SO4)2��12H2O]���������Ʊ�Al��K2SO4��H2SO4�Ĺ�������������ʾ��
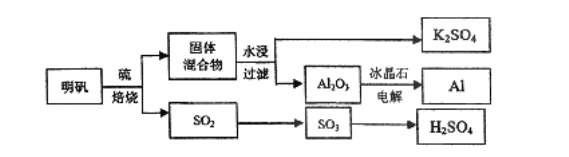
���������Ļ�ѧ����ʽΪ��4KAl(SO4)2��12H2O��3S=2K2SO4��2Al2O3��9SO2����48H2O
��ش��������⣺
��1���ڱ��������ķ�Ӧ�У���������________���������뻹ԭ�������ʵ���֮��Ϊ_________
��2����ˮ�������Һ�еõ�K2SO4����ķ�����____������K2SO4��KԪ�صļ�������������____��
��3����������Һ����μ���Ba(OH)2��Һ��SO42-ǡ�ó�����ȫ�����ӷ�Ӧ����ʽΪ____��
��4�����ղ�����SO2�����������ᡣ��֪25�桢l0lkPaʱ��
��2SO2(g)��O2(g) ![]() 2SO3(g) ��H1=��197kJ��mol��1
2SO3(g) ��H1=��197kJ��mol��1
��H2O(g)=H2O(l) ��H2=��44kJ��mol��1
��2SO2(g)��O2(g)��2H2O(g)=2H2SO4(l) ��H3=��545kJ��mol��1
��SO3��g����H2O��1����Ӧ���Ȼ�ѧ����ʽ��__________________________��
��5����������������û��������ʧ���������������ղ���K2SO4��Al��H2SO4�����ʵ���֮��Ϊ___________.
���𰸡� KAl(SO4)2��12H2O 1��1 �����ᾧ �ýྻ�IJ�˿������˿��պȡ������Һ�����ƾ��ƻ��������գ�����ɫ�ܲ����۲쵽�������ɫ��֤��Ӧ�м����� Al3++2 SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O SO3(g)+ H2O(l)=H2SO4(l)����H=-130kJ/mol 2:4:9
����������1�����ݱ��յķ�Ӧ��4KAl(SO4)2��12H2O��3S=2K2SO4��2Al2O3��9SO2����48H2O����Ӧǰ�����е�8��+6�۵�S����Ӧ����2��������ص�+6��������6��ת��Ϊ+4�۵�SO2����Ӧǰ3��0�۵���S����Ӧ��ת��Ϊ3��ת��Ϊ+4�۵�SO2������������Ϊ��������KAl(SO4)2��12H2O����Ӧ����������6��+6��S���ϼ۽���������������Ϊ3��KAl(SO4)2��12H2O����3��0��S���ϼ���������ԭ��Ϊ3��S�������������뻹ԭ�������ʵ���֮��Ϊ1:1��
��2������Һ�еõ�����أ�������Һ�еõ��������ʵķ���Ӧ���������ᾧ������K2SO4��KԪ�صļ������������ǣ�ʵ�ʾ���K+�ļ�����̣�Ӧ�ò�����ɫ��Ӧ���м��𣬷����ǣ��ýྻ�IJ�˿������˿��պȡ������Һ�����ƾ��ƻ��������գ�����ɫ�ܲ����۲쵽�������ɫ��֤��Ӧ�м�������
��3����������Һ����μ���Ba(OH)2��Һ��SO42-ǡ�ó�����ȫ������������������Ӧ�õķ�Ӧ������1:2����ʱ�����Al3+��OH-�����ʵ���֮��Ϊ1:4������ת��Ϊƫ��������ӣ�����ʽΪ��Al3++2 SO42-+2Ba2++4OH-=AlO2-+2BaSO4��+2H2O��
��4������Ӧ�������¼��㣺����(![]() )+����(
)+����(![]() )+����(
)+����(![]() )�õ���SO3(g)+ H2O(l)=H2SO4(l)����H=-130kJ/mol��
)�õ���SO3(g)+ H2O(l)=H2SO4(l)����H=-130kJ/mol��
��5�����ݷ�Ӧ��4KAl(SO4)2��12H2O��3S=2K2SO4��2Al2O3��9SO2����48H2O������2mol K2SO4��ͬʱӦ�õõ�2mol Al2O3��9molSO2��2mol Al2O3ת��Ϊ4mol����Al��9molSO2ת��Ϊ9molH2SO4�������������������ղ���K2SO4��Al��H2SO4�����ʵ���֮��Ϊ2:4:9��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���һ���֣�A��B��C��D��E��F��G��X�ֱ����һ��Ԫ�أ�����X�����ڱ��е�λ��û�б������ش������й����⡣

��1��X��AԪ�ظ�������F���γɻ�ѧʽΪXF�����ӻ����X���ʵ��ܶ�С��ˮ����������Ҫ�������X�����ڱ��е�λ���ǵ�______���ڵ�______�壻X������������Ԫ�صĵ����γɵĺϽ���Ҫ��;��_____________________��
��2��A��C�������ƵĻ�ѧ���ʣ���д��A��X������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ______________________��
��3��B��ˮ�����ڸ����·�Ӧ�Ļ�ѧ����ʽ��_______________��
��4��E��һ��������ͨ��F��ˮ��Һ�п��Եõ��������ʣ�д����Ӧ�����ӷ���ʽ��______________________________________________________��
��5����ͬѧ�ж�G��һ��ϡ�����壬�ɴ��жϲ�����G�Ļ������˵���Ƿ���ȷ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ���л�ѧԪ�ص���������ȷ���ǣ� ��
A. ϸ����һ��Ԫ�ص������ܱ�����Ԫ�����
B. ϸ���е������������֬���ᶼ�����е�Ԫ��
C. �����������������ά��ϸ����Ԫ����ɵ�����ȶ�
D. ϸ���е���Ԫ���������ٶ��������Ԫ����Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�Ʒλ���̿���Ҫ�ɷ���MnO2��������Fe3+��Al3+�ȣ����ո��±��պ������������SO2�������Ʊ������̾����ʵ����Դ���ۺ����úͻ���������
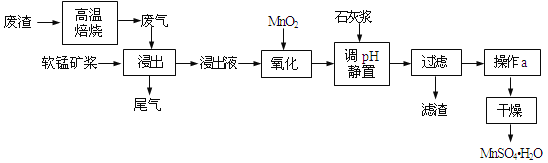
��֪������Һ��pH��2�����еĽ���������Ҫ��Mn2+��������������Fe2+��Al3+�������������ӡ��йؽ��������γ������������ʱ��pH������
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH | �Ӽ��ܽ��pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
��1��д��������������Ҫ��Ӧ�Ļ�ѧ����ʽ_____________________________��Ϊ��������̿�Ľ�ȡ�ʣ����Բ�ȡ�Ĵ�ʩ���˳�ֽ�����У�_____________________�����ٴ���������
��2��д��������������Ҫ��Ӧ�����ӷ���ʽ��_____________________________��
��3�������������Һ���м���ʯ�ҽ������ڵ���pH��pHӦ������______�����������ʯ�ҽ����࣬��ʹ��MnSO4H2O�����к��н϶����ʣ���ԭ����_____________________________��
��4�����и����Լ��У���ȷ�ⶨβ����SO2��������______��ѡ����ţ���
a.NaOH��Һ��Ʒ����Һ b.ϡH2SO4�ữ��KMnO4��Һ c.��ˮ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������ͼװ�ý����Ҵ���������ʵ�飮 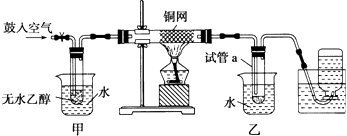
��1��ʵ�������ͭ�����ֺ�ɫ�ͺ�ɫ�����������д���˹����ܵĻ�ѧ��Ӧ����ʽ ��
��2����������ˮԡ���ò���ͬ�����м������� ��
��3����Ӧ����һ��ʱ������Թ�a�����ռ�����ͬ�����ʣ�������ˮ�� �� ����ƿ���ռ������������Ҫ�ɷ��� ��
��4�����Թ�a���ռ�����Һ������ɫʯ����ֽ���飬��ֽ�Ժ�ɫ��˵��Һ���л��������ᣬҪ��ȥ�����ʣ������ڻ��Һ�м���������ĸ��ţ���Ȼ����ͨ������ʵ��������ƣ��������ɳ�ȥ��
a���Ȼ�����Һ b���� c��̼��������Һ d�����Ȼ�̼��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״����Ҷ������������зֱ���������Ľ����Ʋ������������������ͬ�����������������ִ������ʵ���֮���ǣ� ��
A.2��3��6
B.6��3��2
C.4��3��1
D.3��2��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л�����п��������ԣ���Ԫ�صIJ�����Ϣ����ͼ��������˵������ȷ����

A. x=2
B. ��Ԫ����̼Ԫ��λ��ͬһ�壬���ڢ�A��
C. ��λ��Ԫ�����ڱ���4���ڣ�ԭ�Ӱ뾶����̼��ԭ�Ӱ뾶
D. ������ԭ�Ӻ˽�Զ�������˶��ĵ��������ϵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Fe��OH��3��s����Cu��OH��2��s���ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���ҺpH������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ�����ǣ������� 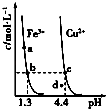
A.Ksp[Fe��OH��3]��Ksp[Cu��OH��2]
B.Fe��OH��3��Cu��OH��2�ֱ���b��c�����������Һ�дﵽ����
C.������NH4Cl�����ʹ��Һ��a��䵽b��
D.c��d�����������Һ��c��H+����c��OH�����˻����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
A. ��Ԫ�ؾ��ǿ��п���Ԫ��
B. ��Ԫ����Ҫ��ָCu��Fe��B��Mn��
C. ȱ����Ԫ�������Ҫ�ܵ�Ӱ��
D. ��Ԫ��Ҳ�������ͷ�����繲�е�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com