
【题目】利用低品位软锰矿浆(主要成分是MnO2,少量的Fe3+、Al3+等)吸收高温焙烧含硫废渣产生的SO2废气,制备硫酸锰晶体可实现资源的综合利用和环境治理。
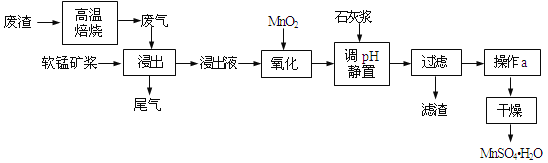
已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子。有关金属离子形成氢氧化物沉淀时的pH见表:
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 加碱溶解的pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
(1)写出浸出过程中主要反应的化学方程式_____________________________。为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还有:_____________________(至少答两点)。
(2)写出氧化过程中主要反应的离子方程式:_____________________________。
(3)①在氧化后的液体中加入石灰浆,用于调节pH,pH应调节至______。②若加入的石灰浆过多,会使得MnSO4H2O晶体中含有较多杂质,其原因是_____________________________。
(4)下列各组试剂中,能准确测定尾气中SO2含量的是______(选填序号)。
a.NaOH溶液、品红溶液 b.稀H2SO4酸化的KMnO4溶液 c.碘水、淀粉溶液
【答案】 SO2+MnO2=MnSO4 适当升温、缓慢通气等 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O 4.7~8.3 若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子 bc
【解析】高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+、Ca2+三种阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂,然后调节pH值在4.7~8.3间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,同时生成微溶的硫酸钙,过滤,滤渣主要有氢氧化铁、氢氧化铝、硫酸钙,由于制取的MnSO4H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4H2O。
(1)低品位软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,反应的化学方程式为SO2+MnO2=MnSO4,为了提高软锰矿的浸取率,可以采取的措施除了充分搅拌外还可以适当升温、缓慢通气等,故答案为:SO2+MnO2=MnSO4;适当升温、缓慢通气;
(2)杂质离子中只有Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O,故答案为:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O;
(3)①杂质中含有Fe3+、Al3+阳离子,从图可表以看出,大于4.7可以将Fe3+和Al3+除去,小于8.3是防止Mn2+也沉淀,所以只要调节pH值在4.7~8.3间即可,故答案为:4.7~8.3;
②若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子,离子反应方程式为:Al(OH)3+OH-═AlO2-+2H2O,故答案为:若加入的石灰浆过多,氢氧化铝与氢氧化钙反应生成偏铝酸根离子(或Al(OH)3+OH-═AlO2-+2H2O);
(4)a.二氧化硫和氢氧化钠反应生成亚硫酸钠,亚硫酸钠和二氧化硫、水又能反应生成亚硫酸氢钠,有两步反应,所以无法准确测定尾气中SO2含量,故a错误;b.稀H2SO4酸化的KMnO4溶液和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故b正确;c.碘和二氧化硫能发生氧化还原反应而使溶液褪色,只发生一步反应,所以能准确测定尾气中SO2含量,故c正确;故答案为:bc。


科目:高中化学 来源: 题型:
【题目】下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:试样 ![]()
![]() 白色沉淀
白色沉淀 ![]() 沉淀不溶解→说明试样已变质
沉淀不溶解→说明试样已变质
B.除去粗盐中含有的硫酸钙杂质:粗盐 ![]()
![]()
![]()
![]()
![]()
![]() 精盐
精盐
C.检验某溶液中是否含有Fe2+:试样 ![]() 溶液颜色无变化
溶液颜色无变化 ![]() 溶液变红色→溶液中含有Fe2+
溶液变红色→溶液中含有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:NaI溶液 ![]()
![]() 溶液变紫色→氧化性:H2O2>I2
溶液变紫色→氧化性:H2O2>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属单质A经如图所示的过程转化为含氧酸D,已知D为强酸,请回答下列问题。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)若A在常温下为固体,B是能使品红溶液褪色的有刺激性气味的无色气体:
①D的化学式是________;
②在工业生产中,B气体的大量排放被雨水吸收后形成了________而污染了环境。
(2)若A在常温下为气体,C是红棕色的气体:
①A、C的化学式分别是:A________;C________。
②D的浓溶液在常温下可与铜反应并生成C气体,请写出该反应的化学方程式_______________________________________________。该反应________(填“属于”或“不属于”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国本土科学家屠呦呦因为发现青蒿素而获得2015年的诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( ) 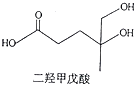
A.与乙醇发生酯化反应生成产物的分子式为C8H18O4
B.能发生加成反应,不能发生取代反应
C.在铜的催化下与氧气反应的产物可以发生银镜反应
D.标准状况下1mol该有机物可以与足量金属钠反应产生22.4L H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag铁和氧化铁的混合物加入800mL0.1mol/L 的盐酸中充分反应后,盐酸全部消耗,放出标准状兄下气体0.224L。则下列判断中正确的是 ( )
A. 原混合物中n (Fe) :n (Fe2O3) =2: 1 B. 向溶液中滴入KSCN 溶液,显血红色
C. 无法计算出原混合物的质量 D. 此混合物中铁元素的质量分数为68.6%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺流程如下所示:
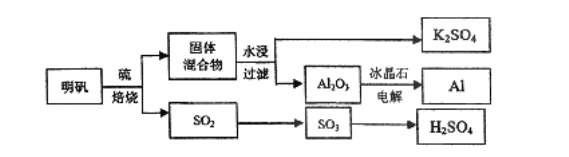
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是________,氧化剂与还原剂的物质的量之比为_________
(2)从水浸后的滤液中得到K2SO4晶体的方法是____;产物K2SO4中K元素的鉴定操作过程是____。
(3)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全的离子反应方程式为____。
(4)焙烧产生的SO2可用于制硫酸。已知25℃、l0lkPa时:
①2SO2(g)+O2(g) ![]() 2SO3(g) △H1=-197kJ·mol-1
2SO3(g) △H1=-197kJ·mol-1
②H2O(g)=H2O(l) △H2=-44kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)=2H2SO4(l) △H3=-545kJ·mol-1
则SO3(g)与H2O(1)反应的热化学方程式是__________________________。
(5)假设整个过程中没有物质损失,理论上三种最终产物K2SO4,Al和H2SO4的物质的量之比为___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活、科技、环境等密切相关,下列说法正确的是:
A. 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸
B. 可以用氢氧化钠鉴别地沟油和矿物油
C. 用漂白精和洁厕灵(主要成分是盐酸)混合后的浓溶液清洗马桶效果更好
D. 明矾可以用于海水提纯制淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~E等几种烃分子的球棍模型如图所示,据此回答下列问题.

(1)D的分子式为________,A的二氯取代物有_______种,属于同系物的是_________(填字母)。
(2)有关有机物E的结构或性质的说法正确的是________(填字母)。
a.是碳碳双键和碳碳单键交替的结构
b.有毒、不溶于水、密度比水小
c.不能使酸性KMnO4溶液和溴的四氯化碳褪色
d.一定条件下能与氢气或氧气反应
(3)已知有机物C能与HCN反应,原理与其和H2O反应类似,请写出相关的化学反应方程式:_________________,反应类型_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com