
����Ŀ���ǽ�������A����ͼ��ʾ�Ĺ���ת��Ϊ������D����֪DΪǿ�ᣬ��ش��������⡣
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��1����A�ڳ�����Ϊ���壬B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ����:
��D�Ļ�ѧʽ��________��
���ڹ�ҵ�����У�B����Ĵ����ŷű���ˮ���պ��γ���________����Ⱦ�˻�����
��2����A�ڳ�����Ϊ���壬C�Ǻ���ɫ������:
��A��C�Ļ�ѧʽ�ֱ��ǣ�A________��C________��
��D��Ũ��Һ�ڳ����¿���ͭ��Ӧ������C���壬��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________________________________���÷�Ӧ________(����������������������)������ԭ��Ӧ��
���𰸡� H2SO4 ���� N2 NO2 Cu��4HNO3(Ũ)===Cu(NO3)2��2NO2����2H2O ����
���������ǽ�������A��ת��Ϊ������D��DΪǿ�ᣬB��C�����������AԪ��Ϊ�ɱ��Ԫ�أ�����������Ԫ����S��NԪ�أ���A�ǵ��������ʡ�(1)��A�ڳ�����Ϊ���壬��A��S���ʣ�B����ʹƷ����Һ��ɫ���д̼�����ζ����ɫ���壬��B��SO2����������������������������C��SO3�����������ˮ��Ӧ�������ᣬ��D��H2SO4����ͨ�����Ϸ���֪��D�����ᣬ�仯ѧʽΪ��H2SO4����B�Ƕ��������������ˮ��Ӧ���������ᣬ������ȶ��ױ������������ᣬ������Һ�����ԣ���ˮ�к���������γ����ꣻ(2)��A�ڳ�����Ϊ���壬C�Ǻ���ɫ���壬��A��N2��C��NO2��B��NO��D��HNO3����ͨ�����Ϸ���֪��A��C�Ļ�ѧʽ�ֱ��ǣ�N2��NO2���ڳ����£�ͭ��Ũ���ᷴӦ��������ͭ������������ˮ����Ӧ����ʽΪCu��4HNO3(Ũ)��Cu(NO3)2��2NO2����2H2O����Ӧ��ͭ�͵�Ԫ�ػ��ϼ۱仯������������ԭ��Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ4��̼ԭ�����ϵķ�ʽ��С���ʾ̼ԭ�ӣ�С����ʾ��ѧ��������̼ԭ��������Ļ�ѧ�����������ϡ�

��1��ͼ��������������_________������ϩ������_______(����ĸ)��
��2����ͼ�л�Ϊͬ���칹�����A��____�� B��______��D��____(����ĸ)��
��3��C�Ļ�ѧʽΪ____________����һ�ȴ����ͬ���칹����___�֡�
��4��д��B���Ȼ��ⷴӦ�Ļ�ѧ��Ӧ����ʽ��__________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ�����ڱ���һ���֣�A��B��C��D��E��F��G��X�ֱ����һ��Ԫ�أ�����X�����ڱ��е�λ��û�б������ش������й����⡣

��1��X��AԪ�ظ�������F���γɻ�ѧʽΪXF�����ӻ����X���ʵ��ܶ�С��ˮ����������Ҫ�������X�����ڱ��е�λ���ǵ�______���ڵ�______�壻X������������Ԫ�صĵ����γɵĺϽ���Ҫ��;��_____________________��
��2��A��C�������ƵĻ�ѧ���ʣ���д��A��X������������Ӧ��ˮ����֮�䷴Ӧ�����ӷ���ʽ______________________��
��3��B��ˮ�����ڸ����·�Ӧ�Ļ�ѧ����ʽ��_______________��
��4��E��һ��������ͨ��F��ˮ��Һ�п��Եõ��������ʣ�д����Ӧ�����ӷ���ʽ��______________________________________________________��
��5����ͬѧ�ж�G��һ��ϡ�����壬�ɴ��жϲ�����G�Ļ������˵���Ƿ���ȷ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��R����Ϊǰ������Ԫ����ԭ��������������X�Ļ�̬ԭ�Ӻ�����7�ֲ�ͬ�˶�״̬�ĵ��ӣ�Yԭ���������2�ԳɶԵ��ӣ�Z��ԭ������ΪY��ԭ��������2����W3+�Ļ�̬����3d���Ϊ�����״̬��R��������������Һ�����ڼ��������ǵĴ��ڣ�
��ش��������⣺
��1��X2�����ЦҼ��ͦм���Ŀ���� ��
��2��R�ľ����ṹ��ͼ��ʾ���þ�����������ԭ�Ӹ����� �� 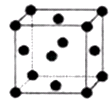
��3�������й�X��Y��W��˵����ȷ���� ��
��X�ĵ�һ��������ͬ��Ԫ������С
�ڳ����£�Y���⻯����Ӽ�������
��XY3����X���ӻ��������Ϊsp3�ӻ�
��W����d����Ԫ��
��4����X����̬�⻯���ˮ��Һ����R��������������Һ�У��ɵ�����ɫ��Һ���÷�Ӧ�����ӷ����� ��
��5����Na2Y2��W2+�������ΰ����ʵ���֮��Ϊ1��1��ϲ�Ͷ��ˮ�У���Һ�г��ֺ��ɫ����������ɫ����������÷�Ӧ�����ӷ���ʽ�� ��
��6����X3����Ϊ�ȵ�����ķ������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���ѧ����������ίԱ����ȷ����116��Ԫ��Lv������Ϊ�W������![]() �������������
�������������
A. ԭ������116 B. ������177
C. ���������116 D. ���ԭ������293
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС������ͼװ���о�Cl2�����ʡ�
| ��� | X | ʵ������ |
�� | AgNO3��Һ | ����a | |
�� | ���۵⻯����Һ | ��Һ���� | |
�� | ��ɫʯ����Һ | ��Һ�ȱ�����ɫ | |
�� | Na2SO3��Һ | ���������� |
��ش�
��1��ʵ����У�����a��______��
��2������ʵ����ƶ�Cl2�Ļ�ѧ������______��
��3������ʵ���ϻ�ѧ����ʽ˵�����������ԭ��______��
��4��ʵ��������������֤����Ӧ�����ˣ�����ʵ�鷽��______��
��5��������ӷ���ʽ˵��ʵ����NaOH��Һ��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ϸ���л�ѧԪ�ص���������ȷ���ǣ� ��
A. ϸ����һ��Ԫ�ص������ܱ�����Ԫ�����
B. ϸ���е������������֬���ᶼ�����е�Ԫ��
C. �����������������ά��ϸ����Ԫ����ɵ�����ȶ�
D. ϸ���е���Ԫ���������ٶ��������Ԫ����Ҫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����õ�Ʒλ���̿���Ҫ�ɷ���MnO2��������Fe3+��Al3+�ȣ����ո��±��պ������������SO2�������Ʊ������̾����ʵ����Դ���ۺ����úͻ���������
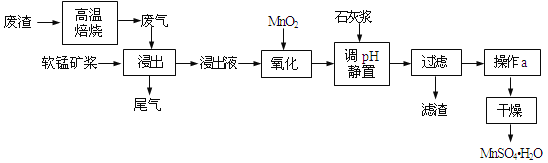
��֪������Һ��pH��2�����еĽ���������Ҫ��Mn2+��������������Fe2+��Al3+�������������ӡ��йؽ��������γ������������ʱ��pH������
���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH | �Ӽ��ܽ��pH |
Fe2+ | 7.6 | 9.7 | |
Fe3+ | 2.7 | 3.7 | |
Al3+ | 3.8 | 4.7 | >8.5 |
Mn2+ | 8.3 | 9.8 |
��1��д��������������Ҫ��Ӧ�Ļ�ѧ����ʽ_____________________________��Ϊ��������̿�Ľ�ȡ�ʣ����Բ�ȡ�Ĵ�ʩ���˳�ֽ�����У�_____________________�����ٴ���������
��2��д��������������Ҫ��Ӧ�����ӷ���ʽ��_____________________________��
��3�������������Һ���м���ʯ�ҽ������ڵ���pH��pHӦ������______�����������ʯ�ҽ����࣬��ʹ��MnSO4H2O�����к��н϶����ʣ���ԭ����_____________________________��
��4�����и����Լ��У���ȷ�ⶨβ����SO2��������______��ѡ����ţ���
a.NaOH��Һ��Ʒ����Һ b.ϡH2SO4�ữ��KMnO4��Һ c.��ˮ��������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�Fe��OH��3��s����Cu��OH��2��s���ֱ�����Һ�дﵽ�����ܽ�ƽ��ı���ҺpH������������Ũ�ȵı仯��ͼ��ʾ����ͼ�����������жϴ�����ǣ������� 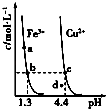
A.Ksp[Fe��OH��3]��Ksp[Cu��OH��2]
B.Fe��OH��3��Cu��OH��2�ֱ���b��c�����������Һ�дﵽ����
C.������NH4Cl�����ʹ��Һ��a��䵽b��
D.c��d�����������Һ��c��H+����c��OH�����˻����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com