
 CH3OH(g),现模拟并分析该反应:
CH3OH(g),现模拟并分析该反应: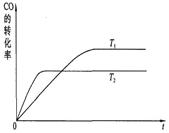
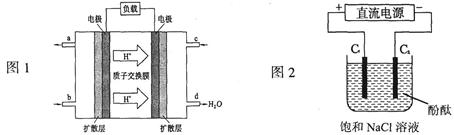
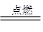 2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分)
2CO2+4H2O(2分);②O2+4e-+4H+=2H2O(2分) Cl2↑+H2↑+2OH-(3分) C2 (2分)
Cl2↑+H2↑+2OH-(3分) C2 (2分)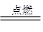 2CO2+4H2O。
2CO2+4H2O。 Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。

科目:高中化学 来源:不详 题型:单选题
 2HI(g)达到平衡状态的是 ( )
2HI(g)达到平衡状态的是 ( )| A.混合气体的压强恒定不变 | B.混合气体的密度不再改变 |
| C.H2、I2、HI的浓度相等 | D.I2在混合气体中的体积分数不再改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| t / s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3) mol | 0 | 0. 16 | 0. 19 | 0. 20 | 0. 20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是
xC(g) + yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(L·min),D的平衡浓度为0.3mol/L,又知v(B) : v(C)="3" : 2,则下列说法中正确的是查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )
2C(g)若经2s 后测得C的浓度为0.6mol?L-1现有下列几种说法其中不正确的是 ( )| A.用物质A表示的反应的平均速率为0.3 mol?L-1?s-1 | B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% | D.2s时物质B的浓度为0.7 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ACl>BCl>CCl | B.CCl>ACl>BCl |
| C.CCl>BCl>ACl | D.BCl>ACl>CCl |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2C(g)
2C(g) 
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.30%和H2O2溶液中加入MnO2可制得O2,MnO2做氧化剂 |
| B.SO2和CO2都属于酸性氧化物,Na2O和Al2O3都属于碱性氧化物[ |
| C.在NH4Cl水溶液中,既存在水解平衡,又存在电离平衡 |
| D.O2在放电条件下生成O3属于化学变化,煤干馏得到焦炭属于物理变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com