
| A��ACl��BCl��CCl | B��CCl��ACl��BCl |
| C��CCl��BCl��ACl | D��BCl��ACl��CCl |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Һ�����ӵ������5�� |
| B����ˮϡ��ʱ��Һ����������Ũ�Ⱦ���С |
| C�������¶ȣ�ƽ����ٽ�ˮ��ķ����ƶ� |
| D�������������ƹ��壬����ʹ��Һ��c(Na+) : c(CO32-)=2:1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2B(g)+C(g)������ӦΪ���ȷ�Ӧ����ҪʹB�����ʵ�����������Ӧ���ʽ��ͣ��ɲ�ȡ�Ĵ�ʩ��
2B(g)+C(g)������ӦΪ���ȷ�Ӧ����ҪʹB�����ʵ�����������Ӧ���ʽ��ͣ��ɲ�ȡ�Ĵ�ʩ��| A������A�����ʵ��� | B����СA�����ʵ��� |
| C��������ϵ���¶� | D����С��ϵ��ѹǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�����淴Ӧ������������Ӧ���ʺ��淴Ӧ������� |
| B����������������ʱ��ʹ�ô���ֻ�ܸı䷴Ӧ���ʣ������ܸı仯ѧƽ��״̬ |
| C����������������ʱ�������¶ȿ���ʹƽ������ȷ�Ӧ�����ƶ� |
| D����������������ʱ������ѹǿһ�����ƻ����巴Ӧ��ƽ��״̬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)����ģ�Ⲣ�����÷�Ӧ��
CH3OH(g)����ģ�Ⲣ�����÷�Ӧ��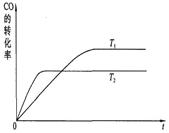
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2SO3�����2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________��
2SO3�����2min��SO2��Ũ����6 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____________����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�� 2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����
2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

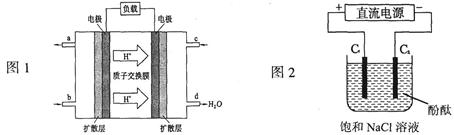
| A��ͼ����a��b���߷ֱ��ʾ��ӦCH2��CH2 (g) + H2(g)��CH3CH3(g)����H< 0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯 |
B��ͼ�ұ�ʾ���º��������·����Ŀ��淴Ӧ2NO2(g)  N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬ N2O4(g)�У������ʵ�Ũ��������������֮��Ĺ�ϵ�����н���A��Ӧ��״̬Ϊ��ѧƽ��״̬ |
C��ͼ�������߱�ʾ��Ӧ2SO2(g) + O2(g)  2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K 2SO3(g)����H < 0 �����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯 |
| D��ͼ������ʼʱHA�����ʵ���Ũ�ȴ���HB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������


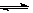 2CO(g)��K1
2CO(g)��K1 H2(g)+CO2(g)��K2
H2(g)+CO2(g)��K2 CO(g)+H2(g)��K3
CO(g)+H2(g)��K3 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 2NO2(g)����H=Q��Q>0�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ�������� ������
2NO2(g)����H=Q��Q>0�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ�������� ������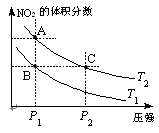
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)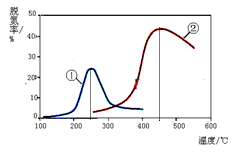
 ����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ�
����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ��鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com