


 2CO(g)��K1
2CO(g)��K1 H2(g)+CO2(g)��K2
H2(g)+CO2(g)��K2 CO(g)+H2(g)��K3
CO(g)+H2(g)��K3 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
 2NO2(g)����H=Q��Q>0�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ�������� ������
2NO2(g)����H=Q��Q>0�������¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵����ȷ�������� ������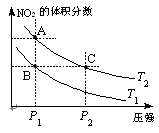
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)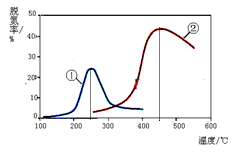
 ����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ�
����˵����ȷ���ǣ�ע���ѵ��ʼ���������ת���ʣ� CO��g��+H2��g�� K3=K1?K2
CO��g��+H2��g�� K3=K1?K2 ��֪����Ӧ�ķ���ʽΪ��C��s��+H2O��g��
��֪����Ӧ�ķ���ʽΪ��C��s��+H2O��g�� CO��g��+H2��g����
CO��g��+H2��g���� 2CO(g)��K1�٣�CO(g)+H2O(g)
2CO(g)��K1�٣�CO(g)+H2O(g)  H2(g)+CO2(g)��K2�ڣ�
H2(g)+CO2(g)��K2�ڣ�  CO(g)+H2(g)��K3�����ۣ��ý���+��=�ۣ�����֪K1��K2��K3֮��Ĺ�ϵΪK3=K1?K2��
CO(g)+H2(g)��K3�����ۣ��ý���+��=�ۣ�����֪K1��K2��K3֮��Ĺ�ϵΪK3=K1?K2�� H2(g) + CO2(g)��
H2(g) + CO2(g)��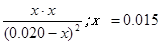 ��ƽ��ʱCO��ת����
��ƽ��ʱCO��ת����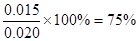
 ��
�� 2NO2(g)����H=Q��Q>0�����¶�Խ�ߣ�NO2(g)�ĺ���Խ�ߣ���T2 > T1��A������ͬ�¶��£�ѹǿԽ�����ԽС�������Ũ��Խ�ߣ���Ӧ����Խ�죬����A��C����ķ�Ӧ���ʣ�A<C��B��ȷ��B��C����NO2(g)�����������ͬ����B��C����������ƽ����Է���������B=C��C����B��A�Ĺ�����NO2(g)�ĵ�������������ü��ȵķ���ʵ�֣�D��ȷ��
2NO2(g)����H=Q��Q>0�����¶�Խ�ߣ�NO2(g)�ĺ���Խ�ߣ���T2 > T1��A������ͬ�¶��£�ѹǿԽ�����ԽС�������Ũ��Խ�ߣ���Ӧ����Խ�죬����A��C����ķ�Ӧ���ʣ�A<C��B��ȷ��B��C����NO2(g)�����������ͬ����B��C����������ƽ����Է���������B=C��C����B��A�Ĺ�����NO2(g)�ĵ�������������ü��ȵķ���ʵ�֣�D��ȷ�� 2N2(g) + 3H2O(g)����ͼ���֪����ͬ�����£���ʼʱ���¶ȵ������ѵ������������¶ȵ������ѵ�����С����ߵ��ʾ�ﵽƽ��״̬��ƽ����������¶��ѵ��ʷ����Ǽ�С�ģ����ԣ��÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��A�����÷�ӦΪ�ǵ������Ӧ��ѹǿ�ĸı�����Ӱ���ѵ��ʣ�����B�������ߢ١�����ߵ��ʾ��Ӧ�ﵽƽ��״̬��C������ͼ�η�����֪�����١��ڷֱ��ʺ���250���450�������ѵ���D��ȷ��
2N2(g) + 3H2O(g)����ͼ���֪����ͬ�����£���ʼʱ���¶ȵ������ѵ������������¶ȵ������ѵ�����С����ߵ��ʾ�ﵽƽ��״̬��ƽ����������¶��ѵ��ʷ����Ǽ�С�ģ����ԣ��÷�Ӧ������Ӧ����Ϊ���ȷ�Ӧ��A�����÷�ӦΪ�ǵ������Ӧ��ѹǿ�ĸı�����Ӱ���ѵ��ʣ�����B�������ߢ١�����ߵ��ʾ��Ӧ�ﵽƽ��״̬��C������ͼ�η�����֪�����١��ڷֱ��ʺ���250���450�������ѵ���D��ȷ��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��ACl��BCl��CCl | B��CCl��ACl��BCl |
| C��CCl��BCl��ACl | D��BCl��ACl��CCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2��g��+H2��g�� ��H��0
CO2��g��+H2��g�� ��H��0�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

 C B. 3A+2B
C B. 3A+2B 2C
2C  2C D .A+3B
2C D .A+3B C
C�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���
B��D�����ֲ�ͬ�����½��У�B��D��ʼŨ��Ϊ0����Ӧ��A��Ũ�ȣ�mol/L���淴Ӧʱ�䣨min���ı仯������±���| ʵ����� | Ũ�ȣ�mol/L�� | ʱ�䣨min�� | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | �� �� | 8000C | 1��0 | 0��80 | O��64 | 0��57 | 0��50 | 0��50 | 0��50 |
| 2 | 8000C | C2 | 0��60 | 0��50 | 0��50 | 0��50 | 0��50 | 0��50 | |
| 3 | 8000C | C3 | 0��92 | 0��75 | 0��63 | 0��60 | 0��60 | 0��60 | |
| 4 | 8200C | 1��0 | 0��40 | 0��25 | 0��20 | 0��20 | 0��20 | 0��20 | |
 B��D��ƽ�ⳣ��= ,
B��D��ƽ�ⳣ��= ,�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3CH2OH(g)+3H2O(g)��
CH3CH2OH(g)+3H2O(g)��  CO2ת����(%) CO2ת����(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 2SO3����ƽ�ⳣ��K=19���ڸ��¶��µ����
2SO3����ƽ�ⳣ��K=19���ڸ��¶��µ���� �̶����ܱ������г�
�̶����ܱ������г� ��C(SO2)=1mol��L��1��C(O2)="1" mol��L��1������Ӧ�ڸ��¶���SO2ת����
��C(SO2)=1mol��L��1��C(O2)="1" mol��L��1������Ӧ�ڸ��¶���SO2ת���� Ϊ80��ʱ���÷�Ӧ
Ϊ80��ʱ���÷�Ӧ (�����Ӧ�����淴Ӧ��) ������С�
(�����Ӧ�����淴Ӧ��) ������С� cC(g)+dD(g) ��H = a kJ��mol
cC(g)+dD(g) ��H = a kJ��mol -1��
-1���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| ��ѧ����ʽ | K (t1 ) | K (t2) |
  2 2 | 1.8  |  |
   |  |  |
   |  |  |
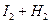  2HI 2HI | 43 | 34 |
 ����HX����ԭ�ӽṹ����ԭ�� ��
����HX����ԭ�ӽṹ����ԭ�� �� ��ѧ���ʵĵݱ��ԣ���ԭ�ӽṹ����ԭ��__________��ԭ�Ӱ뾶�����õ�������������
��ѧ���ʵĵݱ��ԣ���ԭ�ӽṹ����ԭ��__________��ԭ�Ӱ뾶�����õ������������� ��ת��������
��ת�������� ��
�� ��Ӧ�ľ��ҳ̶�����
��Ӧ�ľ��ҳ̶������鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com