
【题目】下列物质中属于电解质的是
A.硫酸铜固体B.铜C.酒精D.氢氧化钠溶液
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能,下图是用固体氧化物作 “直接煤燃料电池”的电解质。有关说法正确的是

A. 电极b为电池的负极
B. 电池反应为:C + CO2 = 2CO
C. 电子由电极a沿导线流向b
D. 煤燃料电池比煤直接燃烧发电能量利用率低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化.如右图所示.下列叙述中正确的是( )
A.ROH是一种弱碱
B.在x点,c(M+)=c(R+)
C.在x点,MOH完全电离
D.稀释前,c(ROH)=10 c(MOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某无色透明溶液中仅含有包括Na+和CH3COO﹣在内的四种离子.
请回答下列问题.
(1)该溶液中的溶质可能有三种情况,请分别写出各种情况的化学式:①②; ③ .
(2)25℃,若由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合,测得混合溶液的pH=8,则c(CH3COOH)+c(H+)的精确值为mol/L.
(3)若该溶液的pH=8,则c(Na+)﹣c(CH3COO﹣)的精确值为mol/L.
(4)当溶液中各离子浓度大小的顺序为c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)时,则该溶液可能是(填序号);
A.由0.1mol/L的CH3COONa溶液与0.1mol/L的CH3COOH溶液等体积混合而成
B.由0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
C.由0.2mol/L的CH3COONa溶液与0.1mol/L的HCl溶液等体积混合而成
D.由0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合而成
(5)常温下,将a mol/L的CH3COOH溶液与0.01mol/L的NaOH溶液等体积混合,反应平衡后溶液中c(Na+)=c(CH3COO﹣),用含a的代数式表示CH3COOH的电离平衡常数Ka= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2.4molA和1.2molB两种气体相混合后于容积为2L的某密闭容器中,发生如下反应A(g)+B(g)x C(g)+D(g)△H<0,2min末反应达到平衡状态,生成了0.8molD,并测得C的浓度为0.4mol/L,请填写下列空白:
(1)x值等于 2min内v(B)= .
(2)A的转化率为 .
(3)该反应达到平衡时,再向容器中加入1.2molA和0.6molB,再次达到平衡后,A的转化率(填“增大”、“减小”或“不变”).
(4)该反应的平衡常数的表达式k= , 450℃时平衡常数500℃时平衡常数(填“大于”、“小于”或“等于”).
(5)相同温度下,若起始时向该容器中充入0.4mol A、0.4mol B、0.2molC和0.2molD,反应达到平衡前,反应速率v正v逆(填“>”或“<”),达到平衡时D的浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
砷主要以硫化物矿的形式(如雄黄,雌黄等)存在于自然界。砷及其化合物主要用于合金冶炼、农药医药、颜料等工业。请根据有关砷及其化合物的转化关系和晶体结构图,回答下列问题:

(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做__________________。
(2)基态砷原子的核外电子排布式为_______________,与砷同周期的p区元素中第一电离能大于砷的元素有_______________ (填元素符号)。
(3)雄黄分子中,As原子的杂化方式为_________________。
(4)雄黄可经过如下三步反应生成雌黄:

①反应Ⅲ的化学方程式为________________________。
②SO2的中心原子的VSEPR构型为______________________。
③亚砷酸属于三元弱酸,酸性:H3AsO3________HNO2(填“>”或“<”),请根据物质结构的知识解释原因:____________________________。
(5)①图3是由Li、Fe和As三种元素组成的超导体化合物的晶体结构(该晶胞是立方晶胞,Li在晶胞内部),该晶体的化学式为_____________________。
②若1号原子的坐标为(0,0,0),2号原子的坐标为(1/4,1/4,1/3),则3号原子的坐标为___________。
③已知该晶胞参数ɑ=0.53nm,阿伏加德罗常数的值为NA,则该晶体的密度为_______g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2(亚氯酸纳)是常用的消毒剂和漂白剂,工业上可采用电解法制备,工作原理如图所示。下列叙述正确的是
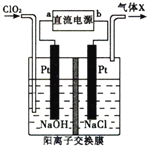
A. 若直流电源为铅蓄电池,则b极为Pb
B. 阳极反应式为ClO2+e-=ClO2-
C. 交换膜左测NaOH的物质的量不变,气体X为Cl2
D. 制备18.1gNaClO2时理论上有0.2molNa+由交换膜左侧向右侧迁移
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com