
����Ŀ����һ���¶��£���2.4molA��1.2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У��������·�ӦA��g��+B��g��x C��g��+D��g����H��0��2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������д���пհף�
��1��xֵ���� 2min��v��B��= ��
��2��A��ת����Ϊ ��
��3���÷�Ӧ�ﵽƽ��ʱ�����������м���1.2molA��0.6molB���ٴδﵽƽ���A��ת���������������С�����䡱����
��4���÷�Ӧ��ƽ�ⳣ���ı���ʽk= �� 450��ʱƽ�ⳣ��500��ʱƽ�ⳣ��������ڡ�����С�ڡ����ڡ�����
��5����ͬ�¶��£�����ʼʱ��������г���0.4mol A��0.4mol B��0.2molC��0.2molD����Ӧ�ﵽƽ��ǰ����Ӧ����v��v������������������ﵽƽ��ʱD��Ũ��Ϊ ��
���𰸡�
��1��1,0.2mol/��L��min��
��2��33.3%
��3������
��4��![]() ,����
,����
��5����,0.15mol/L
���������⣺��һ���¶��£���2.4molA��1.2molB�����������Ϻ����ݻ�Ϊ2L��ij�ܱ������У�2minĩ��Ӧ�ﵽƽ��״̬��������0.8molD�������C��Ũ��Ϊ0.4mol/L������CΪ0.4mol/L��2=0.8mol����
A��g��+ | B��g�� | xC��g��+ | D��g�� | |
��ʼ��mol�� | 2.4 | 1.2 | 0 | 0 |
ת����mol�� | 0.8 | 0.8 | 0.8 | 0.8 |
ƽ�⣨mol�� | 1.6 | 0.4 | 0.8 | 0.8 |
��1�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ�����0.8mol��0.8mol=x��1�����x=1��
v��B��= ![]() =0.2mol/��L��min����
=0.2mol/��L��min����
���Դ��ǣ�1��0.2mol/��L��min����
��2��A��ת����= ![]() ��100%=33.3%��
��100%=33.3%��
���Դ��ǣ�33.3%��
��3���÷�Ӧ�ﵽƽ��ʱ�����������м���1.2molA��0.6molB����ЧΪ��ԭƽ�����������ѹǿ����Ӧǰ�������������䣬����Ӧ��ϵ��ѹǿ��ƽ�ⲻ�ƶ���A��ת���ʲ��䣬
���Դ��ǣ����䣻
��4��A��g��+B��g��xC��g��+D��g���Ļ�ѧƽ�ⳣ������ʽK= ![]() ��
��
����ӦΪ���ȷ�Ӧ�������¶�ƽ�������ƶ���ƽ�ⳣ����С��450��ʱƽ�ⳣ������500��ʱƽ�ⳣ����
���Դ��ǣ� ![]() �����ڣ�
�����ڣ�
��5����Ӧǰ���������ʵ������䣬�����ʵ�������Ũ�ȼ���ƽ�ⳣ������K= ![]() =
= ![]() =1�����ʱŨ����Qc=
=1�����ʱŨ����Qc= ![]() =0.25��K=1����Ӧ������Ӧ���У���v����v����
=0.25��K=1����Ӧ������Ӧ���У���v����v����
��ƽ��ʱת����AΪymol����
A��g��+ | B��g�� | C��g��+ | D��g�� | |
��ʼ��mol�� | 0.4 | 0.4 | 0.2 | 0.2 |
ת����mol�� | y | y | y | y |
ƽ�⣨mol�� | 0.4��y | 0.4��y | 0.2+y | 0.2+y |
���� ![]() =1�����y=0.1
=1�����y=0.1
��ƽ��ʱD��Ũ��Ϊ ![]() =0.15mol/L��
=0.15mol/L��
���Դ��ǣ�����0.15mol/L��
�����㾫�������ջ�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ����ǽ����ĸ�������Ҫ֪����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��С������ѪҺ���鵥�У�������Ϊ5.9��10��3mol/L����ʾ�����ָ����������ǣ� ��
A.�ܽ�ȣ�s��
B.���ʵ���Ũ�ȣ�c��
C.����������w��
D.Ħ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ�¶��£������Ϊ1L�����������ܱ������з������淴Ӧ��A��g��+2B��g��2C��g����H=a kJmol��1 �� ��a��0����ʵ������ʼ��ƽ��ʱ���й��������±���ʾ����������������ǣ�������
���� | ��ʼʱ�����ʵ����ʵ���/mol | �ﵽƽ��ʱ | ||
A | B | C | ||
�� | 1 | 2 | 0 | ����������0.25akJ |
�� | 0.5 | 1 | 1 | ����������Q kJ |
A.�����١����з�Ӧ��ƽ�ⳣ�����
B.ƽ��ʱ������������C�����������ԼΪ18%
C.�������дﵽƽ��ʱ���յ�����Q=0.25a kJ
D.�������������䣬�������ٵ������Ϊ2L����ƽ��ʱ���յ�����С��0.25a kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������Ⱦ����ҪϤ���о���
(1)������������ڴ����������ᡣ���Ṥҵ��,��Ϊ������V2O5�Է�ӦI�Ĵ�ѭ�����̾����ˢ�������Ӧ�Σ���ͼ��ʾ��

���з�����1mol��ѧ������ʱ��Ҫ���յ������������£�
��ѧ�� | S=O(SO2) | S=O(SO3) | O=O(O2) |
����/kJ | 535 | a | 496 |
��Ӧ��ġ�H=-98 kJ ��mol-1,�� a=____________����Ӧ��Ļ�ѧ����ʽΪ______________����2molSO2��1molO2�����ܱ������У���һ�������·�����Ӧ��2SO2(g)+O2(g)![]() 2SO3(g)��ƽ��ʱSO3���������(% )���¶Ⱥ�ѹǿ�ı仯�����ʾ�������ж���ȷ���ǣ�_____________��
2SO3(g)��ƽ��ʱSO3���������(% )���¶Ⱥ�ѹǿ�ı仯�����ʾ�������ж���ȷ���ǣ�_____________��
ѹǿ/MPa �������/% �¶�/�� | 1.0 | 2.0 | 3.0 |
350 | 5.0 | a | b |
415 | c | 40.0 | d |
550 | e | f | 36.0 |
A��b >e
B��415�桢2.0MPaʱO2��ת����Ϊ60%
C����һ���¶Ⱥ�ѹǿ��,����V2O5�������ܼӿ췴Ӧ����,���SO3���������
D��ƽ�ⳣ��K(550��)>K(350��)
(2)�ϴ���SO2,������ԭ��ط��������ᡣͼ�����ӽ���Ĥ��________���ӽ���Ĥ(�������������)��

(3)�о����֣�����ʽ����������Һ��SO2��ϵķ�ʽ��2�֣���һ������Һ�е�ˮ��ϡ���������ʽ�������еĻ���Al2O3��ϣ�ͨ����ȼƲⶨ����Һ��pH�仯���������ͼ��ʾ��

�����������ͼ�仯��ԭ��_______________________________��
(4)ȡ��ȷ�SO3,�ֱ�����¶Ȳ�ͬ���ݻ���ͬ�ĺ����ܱ������У�������Ӧ��3SO3(g)![]() (SO3)3(g) ��H<0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��SO3�İٷֺ���,���������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ��,������ʵ����������ǣ�_____��
(SO3)3(g) ��H<0����Ӧ��ͬʱ��ֱ�ⶨ��ϵ��SO3�İٷֺ���,���������淴Ӧ�¶�(T)�仯�Ĺ�ϵͼ������ʾ��ͼ��,������ʵ����������ǣ�_____��

(5)��Na2SO3��Һ��Ϊ����Һ����SO2ʱ������ΪNaHSO3,��֪���������������ƽ�ⳣ���ֱ�ΪKa1��Ka2��������NaHSO3��Һ�����Եij�Ҫ����Ϊ_____________��(�ú�ΪKa1��Ka2�Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�ٻ������ù�˾��һ���������Ͻ�ϾɼҾ߽��л�������,����������ͼ��ʾ��
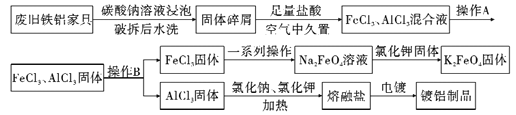
��ش��������⣺
(1)�����м�̼������Һ���ݵ�Ŀ����_______________;�ڿ����о��õ�Ŀ����_________________��
(2)ͬ������Na2FeO4�ܽ��__________K2FeO4�ܽ��(����ڡ��������ڡ��� ����ȷ����),�Ʋ�K2FeO4�ھ�ˮ���������_______________��(���ٴ�����)
(3)��֪K2FeO4ˮ���Լ��ԡ���ϴ��K2FeO4����ʱ���ѡ��__________��
A��ˮ B��������������Һ C������������Һ D��������������Һ���Ҵ�
(4)�����ε������Ԫ�غ���Ԫ����Ҫ��AlCl4-��Al2Cl7-��ʽ����,����Ƶ���Ҫ�缫��ӦʽΪ___________________��(д��һ���缫��Ӧ����)
(5)��֪�Ȼ�����������������̬�Ȼ������ܶ�Ϊ11.92g/L(��ת��Ϊ��״��),����̬�Ȼ����ķ���ʽΪ______________________��
(6)������������������ҩƷ���������ܽⷽʽ�������ܽ�ΪAl3+��[Al(OH)4]-����֪25��ʱ����������pH=3��pH=10������Һ���ܽ�Ⱦ�Ϊ7.8��10-3g(��Һ�ܶȽ���Ϊ1g/mL)����25�������������������ܽⷽʽ���ܶȻ�֮��Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к��д����ķ������Ϻ��ؽ�������ҵ�Ͽ��Դӵ��ӷ���(����������ֻ��ϼ�)����ȡ�����Ľ�����ͭ��ÿ�ֵ��ӷ������ܹ���ȡ��130����ͭ��0.45����ƽ��2�����������ȡ�������£�

��ش��������⣺
(1)�����ܡ������У���ˮ���Ӧ�Ļ�ѧ����ʽΪ________________________��
(2)����ȡ�������У������Һ��������Ҫ����Ҫ����Ϊ____________________����������ʹ��ǰ������еIJ���Ϊ____________________________��
(3)����ԭ���Ʊ�����Ag�Ĺ����У�������Ӧ�ı�����Zn��AgCl�ڵ����HCl���γ���أ��ù��̵��ܷ�ӦΪ��2AgCl+Zn=2Ag+ZnCl2����õ�������ĵ缫��ӦʽΪ__________________________��
(4)��������Ҫ�ɷ�ΪCu2(OH)2CO3����ͭ�������з�����Ӧ�����ӷ���ʽΪ______________________��
(5)��ҺΪNaCl��Na2CO3��NaHCO3�Ļ��Һ���������������ʵ����ʵ���Ũ����ͬ������Һ�и�����Ũ�ȵĴ�С˳��Ϊ______________________��
(6)�����±������ݣ��ۺϷ�����ҵ�Ͻ��С���ԭ��������ѡ�õĻ�ԭ�����Ϊ______________��
���� | �۸�Ԫ����-1�� |
˫��ˮ����30%H2O2�� | 3200 |
�̷�����99.0%FeSO4��7H2O�� | 1800 |
���������ƣ���99.5%NaHSO3�� | 2850 |
���ᣨ��99.0%H2C2O4) | 3000 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���CuO�������У�����ȷ����
A.���ڼ���������B.�����ᷴӦ�����κ�ˮ
C.����������D.����ˮ��Ӧ���ɼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС��Ϊ�о��绯ѧԭ���������ͼװ�ã�������������ȷ����

A. a��b������ʱ����Ƭ�ϻ��н���ͭ����
B. a��b�õ�������ʱ����Ƭ�Ϸ����ķ�ӦΪ�� Fe2e===Fe2+
C. a��b�õ�������ʱ�����Ӵ�CuƬ������Ƭ
D. a��b�õ�������ʱ��Cu2+��ͭ�缫�ƶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com