



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、压强增大,平衡向逆反应方向移动 |
| B、Si02是氧化剂,CO是氧化产物 |
| C、上述反应若为放热反应,升高温度,平衡常数将减小 |
| D、上述反应中每生成1mol Si3N4,氮元素得12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用“百度”搜索知,Y、Z形成的化合物“室温下强度高,….导热性好,热膨胀系数小,是良好的耐热冲击材料.”由此可推测该化合物属于离子晶体 |
| B、化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3 |
| C、由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液 |
| D、因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.| 10 |
| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
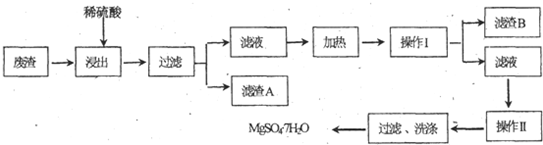
科目:高中化学 来源: 题型:
| H+ |
| ①转化 |
| Fe2+ |
| ②还原 |
| OH- |
| ③沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe2O3和MnO2 |
| B、MnO2和V2O5 |
| C、Cr2O3和V2O5 |
| D、Fe2O3和CuO |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com