
【题目】下列关于NH4Cl的化学用语正确的是
A. 氯离子的结构示意图: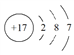
B. 其溶液呈酸性的原因:NH4Cl + H2O NH3·H2O +HCl
C. 工业上“氮的固定”:NH3 + HCl = NH4Cl
D. 比较微粒半径:N>Cl->H
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】向100 mL氢氧化钠溶液中通入一定量的二氧化碳气体充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生二氧化碳的体积(标准状况下)与所加盐酸体积之间的关系如图所示:

据图回答下列问题:
(1)原NaOH溶液的浓度为____________;
(2)标准状况下,通入CO2体积是____________;
(3)所得溶液中溶质的成分和物质的量之比为_______________________(溶质成分用化学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示装置,探究氯碱工业原理,下列说法正确的是

A. 石墨电极与直流电源负极相连
B. 铜电极的反应式为:2H2O+2e-![]() 2OH-+H2↑
2OH-+H2↑
C. 氢氧化钠在石墨电极附近产生, Na+ 向石墨电极迁移
D. 用湿润KI淀粉试剂在铜电极附近检验气体,试纸变蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、碳氧化物是合成可再生能源甲醇的基础原料,具有重要的应用前景。
(1)已知H2(g)、CO(g)和CH4(g)的燃烧热分别为285.8 kJ·mol-1、283.0 kJ·mol-1和890.0 kJ·mol-1。一定条件下,CO与H2合成甲烷的热化学方程式为:CO(g)+3H2(g)==CH4(g)+H2O(1)△H
则△H=________;该反应能自发进行的原因是_____________________________________。
(2)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
反应II:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①一定温度下,在体积可变的恒压密闭容器中加入4molH2和一定量的CO发生反应I,开始时容器体积为2L,CO和CH3OH(g)的浓度随时间变化如图1。10min达到平衡,则反应I的化学平衡常数为______________(结果保留一位小数)。
②恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,下列描述能说明反应II已经达到平衡状态的是________________(填序号)。
A.容器内CO2的体积分数不再变化 B.当CO2和H2转化率的比值不再变化
C.当水分子中断裂2NA个O-H键,同时氢分子中断裂3NA个H-H键
D.容器内混合气体的平均相对分子质量达到34.5,且保持不变
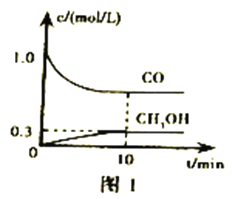
(3)用KOH作电解质的CO碱性燃料电池(如图2)作电源,用惰性电极电解含CN-废水,将CN-彻底氧化为无害气体,以净化废水。该电池的负极反应式为_____________;若开始时正、负两电极区溶液质量相等,当除去1molCN-时,理论上两电极区溶液的质量差为______g。
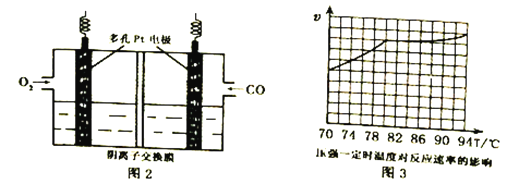
(4)工业上通过CO与甲醇制取甲酸甲酯,热化学方程式为:CO(g)+ CH3OH(g) ![]() HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
HCOOCH3(g)△H =-29kJ·mol-1 。科研人员对该反应进行了研究,部分研究结果如图3。实际工业生产中采用的温度是80℃,其理由是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国稀土资源丰富。下列有关稀土元素![]() 与
与![]() 的说法正确的是( )
的说法正确的是( )
A. ![]() 与
与![]() 的质量数相同
的质量数相同
B. ![]() 与
与![]() 是同一种核素
是同一种核素
C. ![]() 与
与![]() 互为同位素
互为同位素
D. ![]() 与
与![]() 的核外电子数和中子数均为62
的核外电子数和中子数均为62
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A. 从1L 1mol·L-1的NaCl溶液中取出10mL,其浓度仍是1mol·L-1
B. 40g NaOH溶于1L的水中所得的溶液中NaOH物质的量浓度是1mol·L-1
C. 0.5L 2mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D. 制成0.5L 10mol·L-1的盐酸,需要氯化氢气体112L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,浓度均为0.2 mol/L 的NaHCO3 和Na2CO3 溶液中,下列判断不正确的是
A. 均存在电离平衡和水解平衡
B. 存在的粒子种类相同
C. c(OH-)前者大于后者
D. 分别加入少量NaOH固体,恢复到原温度,pH均增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com