
【题目】孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):

(1)反应①能观察到的现象是__________,有关反应的化学方程式为________。
(2)反应②加入的金属可能是______,有关反应的离子方程式为________。
【答案】固体逐渐消失,溶液由无色变成蓝色,有气泡产生 Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O 铁粉 Fe+Cu2+=Fe2++Cu
【解析】
(1)孔雀石的主要成分成为Cu2(OH)2CO3,为碱式盐,和硫酸反应生成二氧化碳气体,得到硫酸铜溶液;(2)硫酸铜溶液中加入过量铁发生氧化还原反应得到金属铜。据此解答。
(1)孔雀石中加入稀硫酸中能观察到的现象是孔雀石逐渐溶解,溶液由无色变为蓝色,且有气泡产生;反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2↑+3H2O;
(2)经过滤除去难溶于水和稀硫酸的杂质,则滤液中主要含有CuSO4,加入的金属粉末能将Cu2+从溶液中置换出来,故金属可能是Fe,反应的离子方程式为Fe+Cu2+=Fe2++Cu。


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】铬是人体必需的微量元素,它与脂类代谢有密切联系,但铬过量会引起污染,危害人类健康。
(1)不同价态的铬毒性不同,三价铬对人体几乎无毒,六价铬的毒性约为三价铬的100倍。电镀厂产生的镀铜废水中往往含有一定量的Cr2O72-,处理该废水常用的流程如下图所示:
![]()
Na2S2O3在此过程中表现________性。若向含Cr3+的废水中加入过量NaOH溶液,会得到NaCrO2溶液,NaCrO2中Cr元素的化合价为_________价,反应的离子方程式为______________________。
(2)交警常用一种“酒精检测仪”检测司机是否酒后驾车。其反应原理如下,请配平该反应方程式:
(_____)CrO3 +(_____)CH3CH2OH +(_____)H2SO4 —(_____)CH3CHO + (_____)Cr2(SO4)3+(_____)H2O
(3)已知存在平衡:2CrO42-+2H+![]() Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
Cr2O72-+H2O。向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2溶液,可析出BaCrO4和PbCrO4两种沉淀,反应的离子方程式为 (任意写出其中一种即可)。此时溶液中c(Pb2+):c(Ba2+)=_________________。
已知Ksp(BaCrO4)=1.25×10-10;Ksp(PbCrO4)=2.75×10-13;
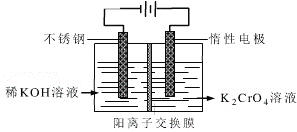
(4)工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备K2Cr2O7,制备装置如图所示(阳离子交换膜只允许阳离子透过)。通电后阳极的电极反应式为____________________。请结合方程式解释反应一段时间后,在阴极室得到浓KOH溶液的原因____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将盐酸滴加到Na2X溶液中,混合溶液的pOH[pOH=—lgc(OH-)]与离子浓度变化的关系如图所示。
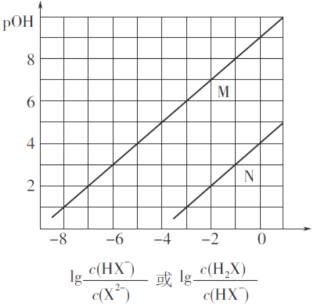
下列叙述正确的是
A. 曲线N表示pOH与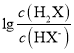 两者的变化关系
两者的变化关系
B. NaHX溶液中c(X2-)>c(H2X)
C. 当混合溶液呈中性时,c(Na+)=c(HX-)+2c(X2-)
D. 常温下,Na2X的第一步水解常数Kh1=1.0×10-4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷燃烧时的能量变化如图,有关说法正确的是( )

A.图1中反应为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=+890.3kJ/mol
B.图2中反应为:CH4(g)+![]() O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
O2(g)=CO(g)+2H2O(g) H=﹣607.3kJ/mol
C.由图可以推得:CO(g)+![]() O2(g)=CO2(g) H=﹣283kJ/mol
O2(g)=CO2(g) H=﹣283kJ/mol
D.由图可以推知:等物质的量的CO2和CO,CO2具有的能量高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
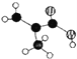
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_____________________,所含官能团的名称为 __________
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为_________________。
(5)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=________________。
CH3COOH + OH–的平衡常数Kh=________________。
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序_________________________,列出质子守恒关系式_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硅广泛存在于自然界中,在日常生活、生产、科研及新型材料等方面有着重要的用途。a~e是对①~⑤反应中SiO2所表现的化学性质或作用进行判断,其中正确的是
①SiO2+2NaOH=Na2SiO3+H2O
②SiO2+2C![]() Si+2CO↑
Si+2CO↑
③SiO2+4HF=SiF4↑+2H2O
④Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
⑤SiO2+3C![]() SiC+2CO↑
SiC+2CO↑
a.反应①中SiO2作为玻璃的成分被消耗,用于刻蚀玻璃
b.反应②中SiO2表现出氧化性
c.反应③中SiO2表现了酸性氧化物的通性
d.反应④符合用难挥发性的酸酐制取易挥发性的酸酐的道理
e.反应⑤中SiO2未参加氧化还原反应
A.aceB.bdeC.cdeD.ab
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶可制得硫酸铜晶体(装置如图1、2所示)。


(1)把浓硝酸分多次加入到铜粉与稀硫酸的混合物中的目的是_______________。
(2)图1烧瓶中发生反应的离子方程式为_____________________________________。
(3)图2是图1的改进装置,其优点除可以防止倒吸外还有:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸是基本有机化工原料之一,广泛用于农药、皮革、染料、医药和橡胶等工业。
(1)已知热化学反应方程式:
I:HCOOH(g)![]() CO(g)+H2O(g) △H1=+72.6kJmol-1;
CO(g)+H2O(g) △H1=+72.6kJmol-1;
II:2CO(g)+O2(g)![]() 2CO2(g) △H 2=-566.0kJmol-1;
2CO2(g) △H 2=-566.0kJmol-1;
III:2H2(g)+O2(g)![]() 2H2O(g) △H 3=-483.6kJmol-1
2H2O(g) △H 3=-483.6kJmol-1
则反应IV:CO2(g)+H2(g)![]() HCOOH(g)的△H =____________kJmol-1。
HCOOH(g)的△H =____________kJmol-1。
(2)查阅资料知在过渡金属催化剂存在下,CO2(g)和H2 (g)合成HCOOH(g)的反应分两步进行:第一步:CO2(g)+H2(g)+M(s)→MHCOOH(s);第二步:___________________。
①第一步反应的△H _________0(填“>”或“<”)。
②第二步反应的方程式为________________________。
③在起始温度、体积都相同的甲、乙两个密闭容器中分别投入完全相同的H2(g)和CO2(g),甲容器保持恒温恒容,乙容器保持绝热恒容,经测定,两个容器分别在t1、t2时刻恰好达到平衡,则t1_________t2(填“>”、“<”或“=”)。
(3)在体积为1L的恒容密闭容器中,起始投料n(CO2)=1mol,以CO2(g)和H2(g)为原料合成HCOOH(g),HCOOH平衡时的体积分数随投料比[ ]的变化如图所示:
]的变化如图所示:

①图中T1、T2表示不同的反应温度,判断T1____________T2(填“〉”、“<”或“=” ) ,依据为____________________。
②图中a=______________。
③A、B、C三点CO2(g)的平衡转化率αA、αB、αC由大到小的顺序为____________。
④T1温度下,该反应的平衡常数K=______________(计算结果用分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组分析了用硫铁矿烧渣(主要成份Fe2O3、Fe3O4、FeO等)制备铁红(Fe2O3)的流程图并进行了铁红性质实验。
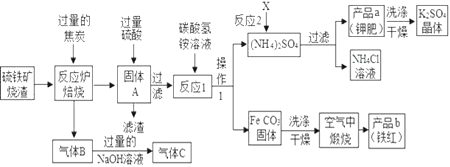
(1)写出焙烧中一氧化碳与氧化铁反应的化学方程式___________。
(2)实验室完成操作1,用到的玻璃仪器有烧杯、玻璃棒和_______(填仪器名称)。
(3)你认为对气体C最佳的处理方法是________。
A.冷却后排入空气B.燃烧后排放C.再通入反应炉
(4)反应1的反应温度一般需控制在35℃以下,其目的是___________。
(5)反应2中相关物质的溶解度如表,你认为该反应在常温下能实现的原因是:________。
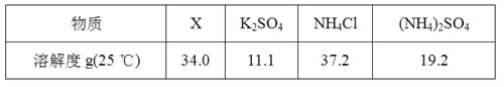
洗涤干燥得到硫酸钾晶体时,可选用下列______(选填序号,下同)洗涤剂
A.氯化钾饱和溶液 B.水 C.硫酸钾饱和溶液
为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入___,振荡、静置,再向上层清液中滴加____,观察现象即可判断。
A.硝酸银溶液 B.过量的氯化钡溶液 C.过量的硝酸钡溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com