
【题目】用系统命法写出下列物质名称或结构简式
(1)C4H10的一氯代物有_____________种。
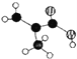
(2)某有机物含C、H、O三种元素,分子模型如图所示(图中球与球之间的连线代表化学键.如单键、双键等)。该有机物的结构简式为_____________________,所含官能团的名称为 __________
(3)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-)/c(H+)=1×10-8。常温下,0. 1 mol·L-1 HA溶液的pH=________;
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,则MOH在水中的电离方程式为_________________。
(5)已知常温时CH3COOH![]() CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O
CH3COO – + H+,Ka=2×10–5,则反应CH3COO – + H2O![]() CH3COOH + OH–的平衡常数Kh=________________。
CH3COOH + OH–的平衡常数Kh=________________。
(6)常温下,若在0.10 mol·L–1 CuSO4溶液中加入NaOH稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________mol·L–1 {Ksp[Cu(OH)2]=2.2×10–20}。
(7)1mol/L Na2C2O4溶液中离子浓度由大到小顺序_________________________,列出质子守恒关系式_____________________
【答案】4种 CH2=C(CH3)COOH 碳碳双键、羧基 3 MOH![]() M+ + OH 5×10–10 2.2×10–8 C(Na+)>C(C2O42-)>C(OH-)>C(HC2O4-)>C(H+) C(OH-)=C(H+)+2C(H2C2O4)+ C(HC2O4-)
M+ + OH 5×10–10 2.2×10–8 C(Na+)>C(C2O42-)>C(OH-)>C(HC2O4-)>C(H+) C(OH-)=C(H+)+2C(H2C2O4)+ C(HC2O4-)
【解析】
(1)C4H10为烷烃,有正丁烷和异丁烷这2种同分异构体,正丁烷的一氯代物有2种,异丁烷的一氯代物有2种,则C4H10的一氯代物有4种;
(2)由分子模型可知,白球是氢原子,黑球是碳原子,半黑球是氧原子,则该有机物的结构简式为CH2=C(CH3)COOH,官能团为碳碳双键和羧基;
(3)由常温下,0.1mol![]() L-1的HA溶液中c(OH-)/c(H+)=1×10–8,可知c(OH–)=10–8c(H+),所以
L-1的HA溶液中c(OH-)/c(H+)=1×10–8,可知c(OH–)=10–8c(H+),所以![]() ,所以
,所以![]() ,所以常温下,0. 1 mol·L–1 HA溶液的pH为3;
,所以常温下,0. 1 mol·L–1 HA溶液的pH为3;
(4)常温下,将0.1mol/L HCl溶液与0.1 mol/L MOH溶液等体积混合,测得混合后溶液的pH=5,说明则MOH为弱碱,所以MOH在水中的电离方程式为:MOH![]() M+ + OH-;
M+ + OH-;
(5)反应CH3COO – ![]() CH3COOH + OH–的平衡常数Kh=
CH3COOH + OH–的平衡常数Kh=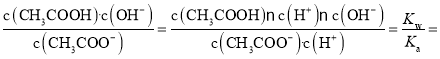 5×10–10;
5×10–10;
(6) 根据溶度积的概念可以直接计算,常温下,pH=8时,c(OH–)=10-6 mol·L–1,由c(Cu2+)·c (OH-) 2=Ksp[Cu(OH)2]得,c(Cu2+)=(2.2×10-20)/10-12 mol·L-1=2.2×10-8 mol·L-1;
(7)1mol/L Na2C2O4溶液中存在:C2O42-+H2O![]() HC2O4-+OH-,HC2O4-+H2O
HC2O4-+OH-,HC2O4-+H2O![]() H2C2O4+ OH-, H2O
H2C2O4+ OH-, H2O![]() H++ OH-,可知C(Na+)>C(C2O42-)>C(OH-)>C(HC2O4-)>C(H+),溶液中存在质子守恒关系式:C(OH-)=C(H+)+2C(H2C2O4)+ C(HC2O4-)。
H++ OH-,可知C(Na+)>C(C2O42-)>C(OH-)>C(HC2O4-)>C(H+),溶液中存在质子守恒关系式:C(OH-)=C(H+)+2C(H2C2O4)+ C(HC2O4-)。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
【题目】以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )
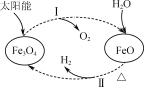
A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量相应的溶质能使溶液恢复到电解前浓度的是
A. AgNO3 B. Na2SO4 C. CuCl2 D. KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是以乙炔(结构简式为![]() )为主要原料合成聚氯乙烯、聚丙烯腈和氯丁橡胶的转化关系图。
)为主要原料合成聚氯乙烯、聚丙烯腈和氯丁橡胶的转化关系图。
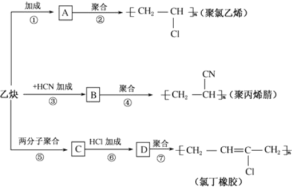
(1)写出A、B、C、D四种物质的结构简式:
A:________,B:________,C:________,D:________。
(2)写出有关反应的化学方程式:
②:____________;
③:_____________;
⑤:___________;
⑦:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )
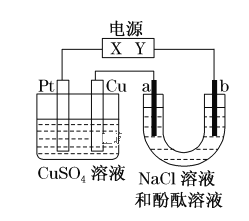
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-=Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3。某同学设计的从孔雀石中冶炼铜的方案如下(假设孔雀石中杂质不溶于水和稀硫酸):

(1)反应①能观察到的现象是__________,有关反应的化学方程式为________。
(2)反应②加入的金属可能是______,有关反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究清洗试管(内壁附着银镜)的反应原理,进行下列实验。
I.初步探究
(1)将稀硝酸加入附着银镜的试管中,记录现象如下:
实验Ⅰ | 实验操作 | 实验现象 |
| 银镜上出现气泡,在液面下方为无色气体,在试管口附近......;试管内壁上的银逐渐溶解。 |
①补全反应中的实验现象___。
②实验Ⅰ中银镜消失发生反应的化学方程式为____。
(2)为消除实验Ⅰ中氮氧化物的污染,将双氧水溶液加入附着银镜的试管中。
实验Ⅱ | 实验操作 | 实验现象 |
| 剧烈反应,有大量无色气体产生,该气体可以使带火星的木条复燃;试管内壁上的银逐渐溶解。 |
①由现象推测H2O2将Ag氧化为Ag+,但通过实验排除了这种可能。该实验方案是:在反应后的液体中,加入___。
②查阅资料发现:该实验中银镜溶解后最终产物为颗粒很小(直径在1~100nm之间)的Ag,其分散在液体中,肉眼无法识别。该同学通过实验证实了这种可能性。他的操作及现象是:___。
③写出该实验Ⅱ中发生反应的化学方程式:___。
II.查阅资料,继续探究
查阅文献:Ag2O+4NH3H2O=2[Ag(NH3)2]++2OH-+3H2O
(3)探究Ag2O在H2O2分解反应中的作用,进行如下实验。
实验Ⅲ | 实验操作 | 实验现象 |
| 剧烈反应,产生大量的无色气体,同时在试管底部仍有少量黑色固体 |
根据实验Ⅲ的现象猜想:Ag2O在反应中作氧化剂。继续实验,在实验Ⅲ反应后的试管中加入足量的溶液x后,固体仍有剩余。由此验证了该猜想的正确。
①在实验中加入足量的溶液x是____。
②实验Ⅲ中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是

A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com