
【题目】我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图)。总反应为CO(NH2)2+H2O=3H2↑+N2↑+CO2↑。下列说法中错误的是

A. a为阳极,CO(NH2)2发生氧化反应
B. b电极反应为:2H2O+2e-=H2↑+2OH-
C. 每转移6mol电子,a电极产生1molN2
D. 电解一段时间,a极区溶液pH升高
【答案】D
【解析】
A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应;
B、阴极产生H2,则阴极反应式为:2H2O+2e-═2OH-+H2↑;
C、阳极的电极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,根据电极反应计算;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液pH降低。
A、电解池工作时,CO(NH2)2失去电子,a为阳极发生氧化反应,故A正确;
B、阴极水得电子产生H2,则阴极反应式为:2H2O+2e-═2OH-+H2↑,故B正确;
C、阳极的电极反应式为:CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,若电路中通过6mol电子,阳极产生N2的物质的量为n(N2)=6mol×1/6=1mol,故C正确;
D、a极发生CO(NH2)2-6e-+H2O═CO2↑+N2↑+6H+,a极区溶液中氢离子浓度增大,溶液的pH降低,故D错误。
故选D。


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】我国科研团队利用低温等离子体协同催化技术,在常温常压下实现了将甲烷和二氧化碳一步转化为具有高附加值的液体燃料和化工产品。回答下列问题:
(1)已知:甲烷和乙酸的燃烧热△H分别为-890.31kJ·mol-1、-876.72kJ·mol-1,试写出甲烷与CO2合成乙酸的热化学方程式:______________。
(2)甲烷和二氧化碳一步转化为液体产品的选择性如下图所示,其中选择性最高的产品是___________,反应中应加入的等离子体催化剂是___________。

(3)在某一钢性密闭容器中CH4、CO2的分压分别为25kPa、30kPa,加入Ni/α-Al2O3催化剂并加热至1123K使其发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
①研究表明CO的生成速率υco=1.28×10-2·p(CH4)·p(CO2) (mol·g-1·s-1),某时刻测得p(H2)=20kPa,则p(CH4)= ____kPa,υco=___mol·g-1·s-1。
②达到平衡后测得体系总压是起始时的1.8倍,则该反应的平衡常数Kp=________(kPa)2(计算结果保留两位有效数字)。
③温度对产物流量及平衡转化率的影响如图所示,可知反应△H____0(填“>”或“<”),原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO310H2O)配制 0.1mol/L 的碳酸钠溶液,正确的方法是
A. 称量 10.6g 碳酸钠晶体,溶解在 1L 水中
B. 称量 28.6g 碳酸钠晶体,溶解在 1L 水中
C. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 1L
D. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W为短周期主族元素,在周期表中的相对位置如图,有下列说法:

①若HmXOn为强酸,则X的氢化物溶于水一定显酸性(m、n均为正整数)
②若四种元素均为金属,则Z的最高价氧化物对应的水化物一定为强碱
③若四种元素均为非金属,则W的最高价氧化物对应的水化物一定为强酸
④若四种元素只有一种为金属,则Z与Y的最高价氧化物对应的水化物一定为强酸。
其中正确的说法有几项( )
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
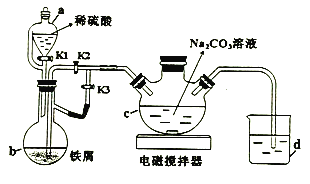
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2015年国产C919大型客机正式下线,标志着我国航空工业进入了新的发展阶段。先进材料首次在国产民用机大规模应用,第三代铝锂合金材料、先进复合材料在C919机体结构用量分别达到8.8%和12%。
(1)飞机的外壳采用第三代铝锂合金材料,我国已基本掌握了航空铝锂合金的熔炼技术。铝原子的外围电子排布式为_________________,电负性大小:锂_____(填“大于”或“小于”)铝,写出氢化锂与水反应的化学方程式 ________________。
(2)现代飞机为了减轻质量而不减轻外壳承压能力,通常采用复合材料,其成分之一为环氧树脂,常见的E51型环氧树脂中部分结构如下图所示:

其中碳原子的杂化方式为__________________。
(3)C919使用的钛材比例为9.3%。钛元素在周期表中位于_____区,钛的最高正化合价为______。
(4)C919制造过程中采用碳化钨做发动机的材料。右图为碳化钨晶体的一部分结构,碳原子嵌入金属钨的晶格的间隙,并不破坏原有金属的晶格,形成填隙化合物。在此结构中,钨原子二维堆积方式为________,1个钨原子周围距离钨原子最近的碳原子有_____个 ,下列金属原子的堆积方式与碳化钨晶胞中碳原子和钨原子所处位置类似的是_________。

A. Cu Ag Au B. Zn Ti Mg C. Na K Fe D. Po
(5)假设该部分晶体的体积为Vcm3,密度为d g/cm3,阿伏加德罗常数为NA个/mol,则碳化钨的摩尔质量M用上述数据可以表示为_______。
(6)大型客机燃油用于四乙基铅做抗震添加剂。四乙基铅是无色油状液体,有臭味,常温下极易挥发。四乙基铅结晶时晶体类型是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com