
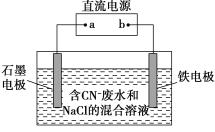
【题目】工业上,在强碱性条件下用电解法除去废水中的CN-,装置如图所示,依次发生的反应有:
①CN--2e-+2OH-=CNO-+H2O
②2Cl--2e-=Cl2↑
③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO![]() +4H2O
+4H2O
下列说法正确的是
A.铁电极上发生的反应为Fe-2e-=Fe2+
B.通电过程中溶液pH不断增大
C.除去1 mol CN-,外电路至少需转移5 mol电子
D.为了使电解池连续工作,需要不断补充NaCl
【答案】C
【解析】
根据电极反应式及图像中有Fe电极可知,阳极为石墨电极,CN-失电子,阴极为铁电极,得电子,可确定a为电池的正极,b为负极。
A.铁电极为电解池的阴极,得电子,则只能是水提供的氢离子得电子,A错误;
B.根据电极反应式,阴极为2H2O+2e-= H2↑+2OH-,阳极①CN--2e-+2OH-=CNO-+H2O,②2Cl--2e-=Cl2↑③3Cl2+2CNO-+8OH-=N2+6Cl-+2CO![]() +4H2O,得失电子数相等时,在消耗氢氧根离子,pH在减小,B错误;
+4H2O,得失电子数相等时,在消耗氢氧根离子,pH在减小,B错误;
C. 根据反应:3Cl2+2CNO-+8OH-═N2+6Cl-+2CO32-+4H2O,除去1mol CN-,消耗1.5mol氯气,转移电子3mol,根据CN--2e-+2OH-═CNO-+H2O,转移电子是2mol,所以外电路至少需转移5mol电子,C正确;
D. 根据电极反应的离子,为了使电解池连续工作,需要补充氢氧化钠,若有氯气溢出,则需要补充氯化钠,D错误;
答案为C。


科目:高中化学 来源: 题型:
【题目】将8.34 g FeSO4·7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示。则下列说法不正确的是

A. 在100℃时,M的化学式为FeSO4·4H2O
B. FeSO4·7H2O晶体中有4种不同结合力的水分子
C. FeSO4·H2O存在的最高温度为373℃
D. 380℃的P加热至650℃时的化学方程式为:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. lmol单质Fe与足量的高温水蒸气反应,失去3NA个电子
B. 27g铝中加入1L 1 mol/L的NaOH溶液,转移电子数是3NA
C. 50mll2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
D. 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有![]() 、
、![]() 、
、![]() 三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是
三种元素的基态原子的电子排布式如下:①1s22s22p63s23p4,②1s22s22p63s23p3,③1s22s22p5。则下列有关比较中正确的是![]()
A. 第一电离能:![]()
B. 简单离子半径:![]()
C. 电负性:![]()
D. 最高价氧化物对应水化物的酸性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是广泛用于橡胶工业的硫化剂,常温下
是广泛用于橡胶工业的硫化剂,常温下![]() 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体,其结构与![]() 类似
类似![]() 下列说法错误的是
下列说法错误的是![]()
A. ![]() 分子中的两个S原子均是
分子中的两个S原子均是![]() 杂化
杂化
B. ![]() 与
与![]() 反应的化学方程式可能为:
反应的化学方程式可能为:![]()
C. ![]() 与
与![]() 结构相似,熔沸点
结构相似,熔沸点![]()
D. ![]() 分子中的S为
分子中的S为![]() 价,是含有极性键和非极性键的非极性分子
价,是含有极性键和非极性键的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,是原电池的装置图。请回答:
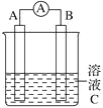
(1)若C为氯化铁溶液,电流表指针发生偏转,A、B电极材料分别为铜和银,则B电极上发生的电极反应式为_______________;
(2)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如图:
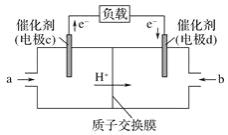
电池总反应为2CH3OH+3O2=2CO2+4H2O,c电极为_极,电极反应方程式为__。若线路中转移6mol电子,则消耗的O2在标准状况下的体积为____ L。
(3)铅蓄电池是最常见的二次电池,放电时的化学方程式为:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)。该蓄电池放电时,电解质溶液中 SO42-移向______(填“正”或“负”)极;正极电极反应方程式为____________;一段时间后,负极增重 48g,转移电子_____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把少量废铁屑溶于过量稀硝酸中,过滤,除去杂质,在滤液中加入过量的氨水,有沉淀生成。过滤,加热沉淀物至质量不再变化,得到红棕色的残渣。上述沉淀和残渣分别为 ()
A.Fe(OH)3;Fe2O3B.Fe(OH)2 ;FeOC.Fe(OH)3 ;Fe(OH)2 ;Fe3O4D.Fe2O3;Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成.丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉.羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的空间构型为:_______;与SCN- 互为等电子体的分子有:__________________(填分子式)
(5)“NiO”晶胞如图:
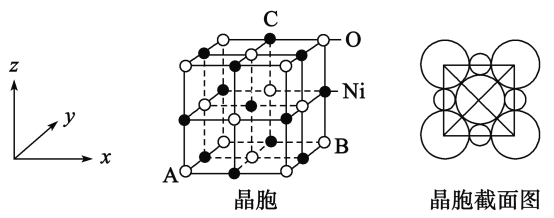
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如图1所示:
图1:
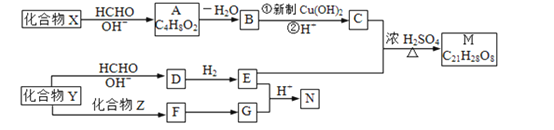
已知:i、-CHO+![]()
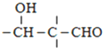
ii、RCHO+![]()
![]()
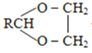 +H2O
+H2O
iii、N的结构简式是
请回答下列问题:
(1)A中含氧官能团名称是______________,由A生成B的反应类型是___________。
(2)写出下列物质的结构简式:X:_________Z:______________E:______
(3)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式是:____。
(4)G中碳原子________(填“一定”、“不一定”或“一定不”)在同一平面内;1mol G一定条件下,最多能与________mol H2发生反应;与G含有相同官能团的同分异构体(不包含G)有___________种。
(5)由Y生成D的化学方程式是________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com