
| A | B | C | |
| 操作 | 3滴0.1mol/LH2SO4溶液 | 1mL1.5mol/LNa2CO3溶液 | 2mL1mol/LBa(OH)2溶液 |
| 现象 |
| A | B | ||
| 操作 | |||
| 现象 | 溶液的红色略有加深 | 有白色沉淀及气体生成,溶液呈紫色 | 溶液变蓝色,有白色沉淀生成 |


科目:高中化学 来源: 题型:
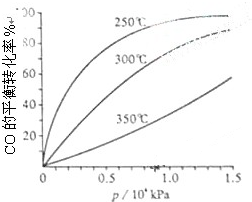 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
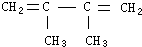 和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )
和b mol CH2=CH-CN加聚形成高聚物A,A在适量氧气中恰好完全燃烧,生成CO2、H2O(气)、N2.在相同条件下它们的体积比为12:8:1,则a:b为( )| A、1:1 | B、1:2 |
| C、2:3 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然药物无毒副作用,所以,多多益善 |
| B、氯气可用作消毒剂和漂白剂,是因为氯气与水反应生成的次氯酸具有强氧化性 |
| C、酸雨指pH值小于7的降水 |
| D、误食重金属盐会中毒,是因为重金属盐能使蛋白质盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将少量的CO2气体通入足量次氯酸钠溶液中的离子方程式为:ClO+CO2+H2O═HCO3-+HClO,可得出电离平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3) |
| B、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1.0×10-3 mol?L-1的AgNO3溶液和1.0×10-3 mol?L-1的K2CrO4溶液混合,不会有沉淀生成 |
| C、相同物质的量浓度的下列溶液:①NH4HS O4 ②NH4Cl ③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
| D、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、此反应可在瞬间产生大量高温气体,推动火箭飞行 |
| B、此反应是氧化还原反应,N2O4是氧化剂 |
| C、每生成1mol N2,该反应转移电子8mol |
| D、此反应中R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2+H2O═H2SO3 | ||||
B、C+CO2
| ||||
C、H2+CuO
| ||||
D、CaCO3
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com