
| A、将少量的CO2气体通入足量次氯酸钠溶液中的离子方程式为:ClO+CO2+H2O═HCO3-+HClO,可得出电离平衡常数K1(H2CO3)>K(HClO)>K2(H2CO3) |
| B、已知Ag2CrO4的Ksp为1.12×10-12,则将等体积的1.0×10-3 mol?L-1的AgNO3溶液和1.0×10-3 mol?L-1的K2CrO4溶液混合,不会有沉淀生成 |
| C、相同物质的量浓度的下列溶液:①NH4HS O4 ②NH4Cl ③NH3?H2O,水电离程度由大到小的顺序是:①>②>③ |
| D、在0.1mol?L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
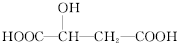 ,下列说法正确的是( )
,下列说法正确的是( )A、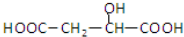 与苹果酸互为同分异构体 与苹果酸互为同分异构体 |
| B、1 mol苹果酸可与3 mol NaOH发生中和反应 |
| C、1 mol苹果酸与足量金属Na反应生成1 mol H2 |
| D、四联苯的一氯代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | |
| 操作 | 3滴0.1mol/LH2SO4溶液 | 1mL1.5mol/LNa2CO3溶液 | 2mL1mol/LBa(OH)2溶液 |
| 现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、K+、OH-、Cl- |
| B、Ba2+、Na+、CO32-、NO3- |
| C、Mg2+、Na+、SO42-、Cl- |
| D、K+、NH4+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、+1 | B、+2 | C、+3 | D、+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 分子代号 | 甲 | 乙 | 丙 | 丁 |
| 电子数 | 10 | 14 | 16 | 18 |
| A、四种气体中至少有两种气体分子互为同分异构体 |
| B、四种气体通入溴的四氯化碳溶液中,都能使其褪色 |
| C、气体丙的所有原子在同一平面上 |
| D、鉴别乙和丙两种气体,可以用酸性高锰酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com