
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,可通过反应:2NO(g)+Cl2(g)2ClNO(g)获得。
(1)氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g)![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=__________(用K1、K2表示)。
(2)300℃时,2NO(g)+Cl2(g)2ClNO(g)的正反应速率表达式为v(正)=k·cn(ClNO),测得速率和浓度的关系如表所示:
序号 | c(ClNO)/(mol/L) | v/(x10-8mol·L-1·S-1) |
① | 0.30 | 0.36 |
② | 0.60 | 1.44 |
③ | 0.90 | 3.24 |
k=__________________________。
(3)按投料比[n(NO):n(Cl2)=2:1]把 NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强p(总压)的关系如图A所示:
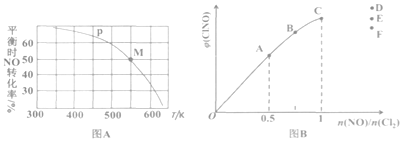
①在p压强条件下,M点时容器内NO的体积分数为______________。
②若反应一直保持在P压强条件下进行,则M点的分压平衡常数KP=________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压 x体积分数)。
(4)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图B所示,则A、B、C三状态中,NO的转化率最大的是________点,当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_______点。
【答案】K12/K2 4×10-8 L/(mol·s) 40% 5/P A D
【解析】
(1)根据3个反应平衡常数表达式判断K3、K1、K2的关系;
(2)取表格中的数据,带入v(正)=k·cn(ClNO)可得k值;
(3)M点时NO的转化率为50%,利用“三段式”计算;
(4)平衡体系中加入NO(g),平衡正向移动,但NO(g)的转化率减小;投料比等于系数比时,产物百分含量最大。
①2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1=
NaNO3(s)+ClNO(g) K1=![]() ,
,
②4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2=
2NaNO3(s)+2NO(g)+Cl2(g) K2=![]() ,③2NO(g)+Cl2(g)
,③2NO(g)+Cl2(g)![]() 2ClNO(g) K3=
2ClNO(g) K3=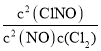
计算得到K3= K12/K2;
(2)![]() ,得n=2,则
,得n=2,则![]() ,K=4×10-8 L/(mol·s);
,K=4×10-8 L/(mol·s);
(3) 2NO(g)+Cl2(g)2ClNO(g)
初始 2a a 0
转化 a 0.5a a
平衡 a 0.5a a
①容器内NO的体积分数为![]() 40%;
40%;
②Kp=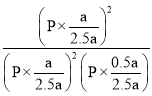 =5/P;
=5/P;
(4)平衡体系中加入NO(g),平衡正向移动,但NO(g)的转化率减小,A、B、C三状态中,A点NO投料比例最小,NO的转化率最大的是A点;投料比等于系数比时,产物百分含量最大,当n(NO)/n(Cl2)=1.5时,比值小于系数比,随NO的增多ClNO的百分含量增大,故选D。


科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的)。其中,甲池为3mol·L-1的AgNO3溶液,乙池为1mol·L-1的AgNO3溶液A、B均为Ag电极。实验开始先断开K1,闭合K2,发现电流计指针发生偏转。下列说法不正确的是

A. 当电流计指针归零后,断开K2,闭合K1,一段时间后B电极的质量增加
B. 断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C. 实验开始先断开K1,闭合K2,此时NO3-向B电极移动
D. 当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 表示阿伏加德罗常数的值。下列关于1 L 0. lmo/L FeCl3溶液的说法中正确的是
A.加热煮沸至溶液呈红褐色时,得到0. 1 NA Fe( OH)3 胶体粒子
B.室温下,加水稀释后,溶液中 c(OH- ) 减小
C.加入0. 3 mol KSCN 溶液,生成0. 1 mol Fe(SCN)3 的红色物质
D.加入0. 15 mol NaOH 固体后 ,3c( Fe3 + ) +c(H+) =c(Na+) +c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:I2在水中溶解度很小,在KI溶液中溶解度显著增大。I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )
I3-(aq)。测得不同温度下该反应的平衡常数如下图所示,下列说法正确的是( )

A. 反应I2(aq)+I-(aq)![]() I3 -(aq)的ΔH>0
I3 -(aq)的ΔH>0
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入CCl4,平衡不移动
D. 25℃时,在上述平衡体系中加入少量KI固体,平衡常数K小于680
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。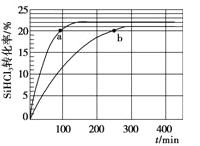
①比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要缩短反应达到平衡的时间,可采取的措施有____。
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=________(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定稀硫酸和氢氧化钠溶液反应的中和热(实验装置如图所示)。
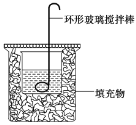
(1)图中尚缺少的一种仪器是________。
(2)实验时环形玻璃搅拌棒的运动方向是________。
a.上下运动 b.左右运动 c.顺时针运动 d.逆时针运动
(3)该同学每次分别取0.50mol·L-1 50mL NaOH溶液和0.50mol·L -1 30mL硫酸进行实验,通过多次实验测定中和热ΔH= -53.5kJ·mol-1,与57.3kJ·mol-1有偏差,产生偏差的原因不可能__(填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定硫酸溶液的温度
(4)在测定中和热的实验中,下列说法正确的是(____)
A.使用环形玻璃棒是为了加快反应速率,减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用0.5mol·L-1 NaOH溶液分别与0.5mol·L-1的盐酸、醋酸溶液反应,如所取的溶液体积相等,则测得的中和热数值相同
D.在测定中和热实验中需要使用的仪器有天平、量筒、烧杯、滴定管、温度计
(5)用相同浓度和体积的氨水代替溶液进行上述实验,测得的中和热![]() H会____(填“偏大”、“偏小”或“无影响”)。
H会____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班几个兴趣小组做了以下实验。
甲组:两同学利用下列试剂:铁粉、0.1mol/L FeCl3溶液、0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+ 的性质,设计实验方案进行实验,完成下列表格。
探究内容 | 实验方案 | 实验现象 | 写出离子方程式 |
①探究Fe2+具有还原性 | 取少FeCl2溶液,加入少量KSCN溶液后,再往溶液中加入少量________。 | 溶液先不变红,后变为血红色。 | Fe2+发生的反应: _____________ |
②探究Fe3+具有氧化性 | 取少量FeCl3溶液,加入足 量______后,振荡,静置,再往溶液中加入少量KSCN溶液。 | 溶液不变为血红色。 | Fe3+发生的反应:________ |
乙组:两同学利用下图所示的装置进行铁与水蒸气反应的实验,并继续研究铁及其化合物的部分性质。
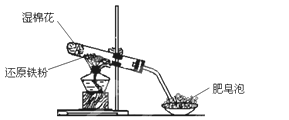
请回答下列问题。
(1)硬质试管中发生反应的化学方程式为_______________。
(2)欲确定反应后硬质试管中固体物质的成分,实验过程如下:
①待硬质试管冷却后,取少许其中的固体物质溶于足量稀硫酸得溶液B;
②取少量溶液B于试管a中,滴加KSCN溶液,溶液没有变红色,则溶液B中的阳离子有_________________,硬质试管中固体物质的成分是_________________。
(3)另取少量溶液B,使其与NaOH溶液反应(按图所示),在胶头滴管挤出NaOH溶液的瞬间可观察到生成白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色。请写出与上述现象中白色沉淀转化红褐色沉淀的化学方程式________________。
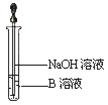
(4)一段时间后,发现a中未变红的溶液变成红色,原因是 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重排反应是指某种化合物在试剂、温度或其他因素的影响下,发生分子中某些基团的转移或分子内碳原子骨架改变的反应。氢化偶氮苯(a)在一定条件下可重排为联苯胺(b),其变化如图所示。下列有关说法不正确的是

A.b分子中所有碳原子可能共平面B.a和b分子的一氯取代物数目相同
C.a和b均能发生氧化反应D.1mol a或b均能与6molH2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学欲除去固体氯化钠中混有的氯化钙,请据如下实验方案回答问题。
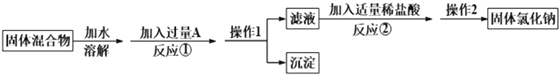
(1)操作1的名称是_____;
(2)反应①中加入略过量的A物质的目的是__________;
(3)写出反应②的化学方程式:_______。
(4)实验时称取样品的质量为185.0g,经过操作1后,测得沉淀(不溶于水)的质量为50.0g, 则样品中NaCl的质量分数是多少___?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com