
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl;②0.1 mol/L CH3COONH4;③0.1 mol/L NH4HSO4;④0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液;⑤0.1 mol/L NH3·H2O,请根据要求填写下列空白:
(1)溶液①呈__________性(填“酸”、“碱”或“中”),其原因是__________。(用离子方程式表示)
(2)比较溶液①、②、③、⑤中c(NH4+)的由大到小的顺序__________。
(3)在溶液④中,__________离子的浓度为0.1 mol/L;NH3·H2O和__________离子的物质的量浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7,则说明CH3COO-的水解程度__________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)_______c(NH4+)(填“>”、“<”或“=”)。
【答案】酸 NH4++H2O![]() NH3·H2O+H+ ③①②⑤ Cl- NH4+ = =
NH3·H2O+H+ ③①②⑤ Cl- NH4+ = =
【解析】
(1)氯化铵溶液中铵根离子水解,结合水电离出的氢氧根离子,促进水的电离平衡正向进行,氢离子浓度增大;
(2)盐是强电解质,完全电离,NH3·H2O是弱电解质,部分电离,等浓度的盐电离产生的离子浓度大于NH3·H2O产生的离子浓度,NH4Cl溶液中由于NH4+水解使溶液显酸性,阳离子、阴离子都水解比单独一种离子水解程度大,向溶液中加入H+会抑制盐的水解,加入OH-会促进离子水解;
(3)④为0.1mol/L NH3H2O和0.1mol/LNH4Cl混合液氯离子浓度为0.1 mol/L,溶液中存在物料守恒,溶液中铵根离子和一水合氨浓度总和为0.2 mol/L;
(4)醋酸根离子水解使溶液显碱性,铵根离子水解使溶液显酸性,室温下测得溶液②0.1 mol/L CH3COONH4溶液的pH=7为中性,说明水解程度相同,溶液中存在电荷守恒。
(1)氯化铵溶液中铵根离子水解,NH4++H2O![]() NH3·H2O+H+,NH4+和水电离出来的结合成NH3H2O,促进水的电离,平衡时使c(H+)>c(OH-),所以溶液呈酸性;
NH3·H2O+H+,NH4+和水电离出来的结合成NH3H2O,促进水的电离,平衡时使c(H+)>c(OH-),所以溶液呈酸性;
(2)盐NH4Cl、CH3COONH4、NH4HSO4都是可溶性强电解质,完全电离产生NH4+,而NH3·H2O是弱电解质,在溶液中只能微弱的电离产生NH4+和OH-,所以等浓度的四种物质的水溶液中,NH3·H2O中NH4+最小;三种盐溶液中都存在铵根离子水解,NH4++H2O![]() NH3·H2O+H+,水解是溶液显酸性,使NH4+浓度降低,在CH3COONH4中同时还存在CH3COO-的水解平衡:CH3COO-+H2O
NH3·H2O+H+,水解是溶液显酸性,使NH4+浓度降低,在CH3COONH4中同时还存在CH3COO-的水解平衡:CH3COO-+H2O![]() CH3COOH+OH-,水解产生OH-会消耗溶液中H+的浓度,使平衡NH4++H2O
CH3COOH+OH-,水解产生OH-会消耗溶液中H+的浓度,使平衡NH4++H2O![]() NH3·H2O+H+正向移动,导致c(NH4+)的比NH4Cl的小;而在NH4HSO4中还电离产生H+,H+浓度增大,使NH4+的水解平衡逆向移动,最终达到平衡时溶液中致c(NH4+)的比NH4Cl大,故①、②、③、⑤溶液中c(NH4+)的由大到小的顺序为③①②⑤;
NH3·H2O+H+正向移动,导致c(NH4+)的比NH4Cl的小;而在NH4HSO4中还电离产生H+,H+浓度增大,使NH4+的水解平衡逆向移动,最终达到平衡时溶液中致c(NH4+)的比NH4Cl大,故①、②、③、⑤溶液中c(NH4+)的由大到小的顺序为③①②⑤;
(3)④为0.1 mol/L NH3H2O和0.1 mol/LNH4Cl混合液,根据溶液成分可知:溶液中Cl-浓度为0.1 mol/L,在该溶液中存在物料守恒,溶液中铵根离子和一水合氨浓度总和为0.2 mol/L;
(4)醋酸根离子水解消耗水电离产生的H+使溶液显碱性,铵根离子水解消耗溶液中的OH-,使溶液显酸性,室温下测得溶液②0.1 mol/LCH3COONH4溶液的pH=7为中性,说明溶液中c(H+)=c(OH-),说明CH3COO-、NH4+的水解程度相同,溶液中电荷守恒为:c(CH3COO-)+c(OH-)=c(H+)+c(NH4+),由于c(H+)=c(OH-),所以c(CH3COO-)=c(NH4+)。


科目:高中化学 来源: 题型:
【题目】某同学设计了一组电化学装置如图所示,其中乙装置中X为阳离子交换膜,甲醇(CH3OH)具有可燃性。

根据要求回答相关问题:
(1)写出装置甲中负极的电极反应式:___。
(2)装置乙中石墨电极(C)的电极反应式为:___。
(3)当装置甲中消耗0.05molO2时,丙装置中阳极产生气体的体积___L(标况下);
(4)装置乙中溶液的pH为___(溶液体积为200mL不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示:甲、乙为相互串联的两电解池。试回答:
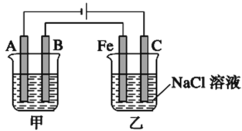
(1)乙池中Fe极电极反应式为___________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈_________色。
(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极名称为_____极,电极反应式为____________,电解质溶液可以是______;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度______(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为________,若此时,乙池剩余溶液为25℃,体积为400 mL,则溶液的pH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室一试剂瓶的标签严重破损,只能隐约看到下列一部分“ ”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
”取该试剂瓶中的试剂,通过燃烧实验测得:16.6g 该物质完全燃烧得到39.6g CO2与9g H2O.
(1)通过计算可知该有机物的分子式为:______.
(2)进一步实验可知:
①该物质能与碳酸氢钠溶液反应生成无色无味气体.
②16.6g 该物质与足量金属钠反应可生成氢气2.24L(已折算成标准状况).则该物质的结构可能有__种,请写出其中任意两种同分异构体的结构简式____.
(3)若下列转化中的D是中可能结构中的一种,且可发生消去反应;E含两个六元环;取C在NaOH水溶液中反应后的混合液,加入足量硝酸酸化后,再加入硝酸银溶液,出现白色沉淀.
![]()
A的结构简式为_____.
(4)写出A转化成B的化学方程式:_____.
(5)反应类型:C→D的①____,D→E_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
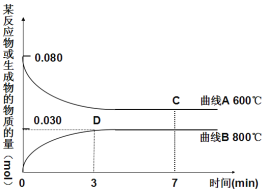
【题目】在2L密闭容器,800℃时发生如下反应:
2CuO(s)+CO(g)![]() Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
Cu2O(s)+CO2(g),n(CuO)随时间的变化如表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
n(CuO)(mol) | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
(1)写出该反应的平衡常数表达式 。
已知:K(400℃)>K(350℃),则该反应是 热反应。
(2)右图中表示Cu2O的物质的量随时间变化的曲线是 (选填“A”或“B”),800℃时,0~3min内该反应的平均速率v (CO2)= 。
(3) 能说明该反应已达到平衡状态的是 。
a.v(CO)=v(CO2) b.容器内压强保持不变
c.v逆(CO)=v正(CO2) d.容器内气体的密度保持不变
(4)能使该反应的正反应速率增大,且平衡向正反应方向移动的是 。
A.增加CuO的量
B.适当升高温度
C.及时移去CO2
D.增大CO的浓度
E.选择高效催化剂
F.增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂空气电池具有使用寿命长、可在自然空气环境下工作的优点。其原理如图所示(电解质为离子液体和二甲基亚砜),电池总反应为:![]() 下列说法不正确的是( )
下列说法不正确的是( )
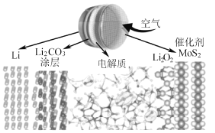
A.充电时电子由Li电极经外电路流入Li2O2
B.放电时正极反应式为2Li++O2 +2e-=Li2O2
C.充电时Li电极与电源的负极相连
D.碳酸锂涂层既可阻止锂电极的氧化又能让锂离子进入电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸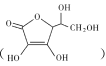 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A. ![]()
B. 
C. ![]()
D. 
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.2mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:

下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.原溶液可能存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
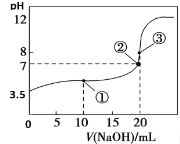
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com