
����Ŀ����ͼ��ʾ���ס���Ϊ������������ء��Իش�
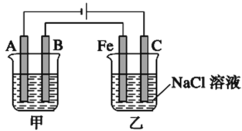
��1���ҳ���Fe���缫��ӦʽΪ___________�������ҳ��е���������̪��Һ����ʼ���һ��ʱ�䣬����������_________ɫ��
��2���׳���Ϊ�õ��ԭ������ͭ(�����ͭ������Ǿ��ȵģ��ұ�����úͲ����õijɷ־�����)��װ�ã���A�缫����Ϊ_____�����缫��ӦʽΪ____________���������Һ������______��ͨ��һ��ʱ���A������12.8g����׳���Һԭ���ʵ�Ũ��______(���������С���������䡱����ȷ����)���ҳ�C(ʯī)���ų������ڱ�״���µ����Ϊ________������ʱ���ҳ�ʣ����ҺΪ25�棬���Ϊ400 mL������Һ��pH��_______��
���𰸡�2H++2e-�TH2�� �� �� Cu2++2e-�TCu CuSO4 ��С 4.48L 14
��������
(1)����װ��ͼ���ҳ��к͵�Դ�������ӵ�C�缫Ϊ������FeΪ��������Һ�е������ӵõ����ӷ�����ԭ��Ӧ������������Һ������������Ũ������
(2)���ݵ�⾫��ԭ������ͭ����������ͭ����������ͭ���ӵĵ������Һ�����ݵ缫��Ӧ��ϵ����غ����ų��������������Ũ�ȣ��Ӷ�������Һ��pH��
(1)����װ��ͼ���ҳ��к͵�Դ�������ӵ�C�缫Ϊ������FeΪ��������Һ�е������ӵõ����ӷ�����ԭ��Ӧ���������������ķ�ӦʽΪ��2H++2e-�TH2������Һ������������Ũ������̪��죬�ʴ�Ϊ��2H++2e-�TH2�����죻
(2)�׳����õ��ԭ������ͭ����ͭ����������ͭ���������ú�ͭ���ӵĵ����Ϊ�������Һ���׳���AΪ������BΪ����������A�缫����Ϊ��ͭ���缫��ӦΪ��Cu2++2e-�TCu��B�缫Ϊ��ͭ��Cu-2e-�TCu2+���������Һ����Ϊ����ͭ��Һ��ͨ��һ��ʱ��׳��������ϴ�ͭ�е�����п�����Ƚ���ʧ���ӣ���Һ��ͭ���ӵõ���������ͭ��������Һ��ԭ���ʵ�Ũ�ȼ�С��A������12.8gΪͭ�����ʵ���=![]() =0.2mol��ת�Ƶ������ʵ���Ϊ0.4mol���ҳ���C�缫Ϊ��������Һ��������ʧ�������������������缫��ӦΪ2Cl--2e-�TCl2���������缫��Ӧ��2H++2e-�TH2������ط�ӦΪ2NaCl+2H2O
=0.2mol��ת�Ƶ������ʵ���Ϊ0.4mol���ҳ���C�缫Ϊ��������Һ��������ʧ�������������������缫��ӦΪ2Cl--2e-�TCl2���������缫��Ӧ��2H++2e-�TH2������ط�ӦΪ2NaCl+2H2O![]() 2NaOH+H2��+Cl2�����ݵ����غ㣬�����������ʵ���0.2mol����Ӧ�����������ʵ���Ϊ0.4mol����״�������=0.2mol��22.4L/mol=4.48L�����������Ӽ��ٺ�����������������ͬ����Һ������������Ũ��=
2NaOH+H2��+Cl2�����ݵ����غ㣬�����������ʵ���0.2mol����Ӧ�����������ʵ���Ϊ0.4mol����״�������=0.2mol��22.4L/mol=4.48L�����������Ӽ��ٺ�����������������ͬ����Һ������������Ũ��=![]() =1mol/L������pH=14���ʴ�Ϊ������Cu2++2e-�TCu��CuSO4����С��4.48L��14��
=1mol/L������pH=14���ʴ�Ϊ������Cu2++2e-�TCu��CuSO4����С��4.48L��14��


 ���Ͱ�ͨ��ĩ���ϵ�д�
���Ͱ�ͨ��ĩ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����ȷ����
A.0.1mol/L��CH3COOH��Һ�У���ˮ�������c��H+��Ϊ10��13 mol/L
B.pH=2��pH=1��CH3COOH��Һ��c��H+��֮��Ϊ1��10
C.������Na+��H+��OH����CH3COO���������ӵ�ij��Һ�п��ܴ��ڣ�c��Na+����c��CH3COO������c��H+����c��OH����
D.1.0 molL��1Na2CO3��Һ��c��OH����=c��HCO3����+c��H+��+2c��H2CO3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ֱ��ʾ���ס�����ȼ��ʱ�������仯���й�˵����ȷ���ǣ� ��
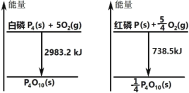
A.���ױȺ����ȶ�
B.����ȼ�ղ���Ⱥ���ȼ�ղ����ȶ�
C.1mol ����ת��Ϊ���ų� 2244.7kJ ������
D.����ȼ�յ��Ȼ�ѧ����ʽ��4P(s)+5O2(g)��P4O10(s)+2954kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1L 0.3 mol/L��NaOH��Һ�л���ͨ��8.8 g CO2���壬ʹ����ȫ��Ӧ���Է�Ӧ�����Һ�������ж���ȷ����
A.����ΪNa2CO3
B.����ΪNa2CO3��NaHCO3�Ļ��������£��û����Һ��������Һ
C.c(Na��)��2[c(HCO3-)��c(CO32-)��c(H2CO3)]
D.c(Na��)��c(H��)��c(HCO3-)��2c(CO32-)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�л���X��Y��Z�����ƺͽṹ��ʽ���±�������˵������ȷ����
X | Y | Z | |
���� | 3-������-4-�ǻ������� | ûʳ�������� | ������ |
�ṹ��ʽ |
|
|
|
A.X��Y��Z������NaOH��Һ��Ӧ
B.X��Y��Ϊͬ���칹�壬X��Z��Ϊͬϵ��
C.����X�����ƣ����Ʋ��Z������Ϊ3��5-��������-4-�ǻ�������
D.�Ʋ��ûʳ����ķ���ʽΪC7H6O5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȷ��ʾ���з�Ӧ�����ӷ���ʽΪ
A. ����������ϡ�����У�FeS+2H+=Fe2++H2S![]()
B. NH4HCO3���ڹ�����NaOH��Һ�У�HCO3-+OH-=CO32-+H2O
C. ����SO2ͨ�뱽������Һ�У�C6H5O-+SO2+H2O=C6H5OH+HSO3-
D. ����ʯ���ڴ����У�CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2![]() +H2O
+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�����ʽ��NaHY��ˮ��Һ�����������У���ȷ����
A. ����ʽ�ε�ˮ��Һһ��������
B. �ڸ�����Һ�У�����Ũ��Ϊ��c(Na+)��c(Y2-)��c(HY-)��c(OH-)��c(H+)
C. ��HY-��ˮ�⣬ˮ�ⷽ��ʽΪ��HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. ��HY-�ܵ��룬���뷽��ʽΪ��HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������£�����������Һ����0.1 mol/L NH4Cl����0.1 mol/L CH3COONH4����0.1 mol/L NH4HSO4����0.1 mol/L NH3��H2O��0.1 mol/L NH4Cl���Һ����0.1 mol/L NH3��H2O�������Ҫ����д���пհף�
(1)��Һ�ٳ�__________��(������������������������)����ԭ����__________��(�����ӷ���ʽ��ʾ)
(2)�Ƚ���Һ�١��ڡ��ۡ�����c(NH4+)���ɴ�С��˳��__________��
(3)����Һ���У�__________���ӵ�Ũ��Ϊ0.1 mol/L��NH3��H2O��__________���ӵ����ʵ���Ũ��֮��Ϊ0.2 mol/L��
(4)�����£������Һ�ڵ�pH=7����˵��CH3COO-��ˮ��̶�__________(����>������<������=��)NH4+��ˮ��̶ȣ�CH3COO-��NH4+Ũ�ȵĴ�С��ϵ�ǣ�c(CH3COO-)_______c(NH4+)(����>������<������=��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������(COCl2)�ķֽⷴӦΪ��COCl2(g)![]() Cl2(g)��CO(g)��H����108kJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ(��10min��14min��COCl2Ũ�ȱ仯����δʾ��)��
Cl2(g)��CO(g)��H����108kJ��mol-1����Ӧ��ϵ�ﵽƽ������ʵ�Ũ���ڲ�ͬ�����µı仯״����ͼ��ʾ(��10min��14min��COCl2Ũ�ȱ仯����δʾ��)��

��1�����㷴Ӧ�ڵ�8minʱ��ƽ�ⳣ��K=__��
��2���Ƚϵ�2min��Ӧ�¶�T(2)���8min��Ӧ�¶�T(8)�ĸߵͣ�T(2)__T(8)(����<������>����������)��
��3����12minʱ��Ӧ���¶�T(8)�����´ﵽƽ�⣬���ʱc(COCl2)=__mol��L-1��
��4���Ƚϲ���CO��2��3min��5��6min��12��13minʱƽ����Ӧ����[ƽ����Ӧ���ʷֱ���v(2��3)��v(5��6)��v(12��13)��ʾ]�Ĵ�С__��
��5���ȽϷ�Ӧ��COCl2��5��6min��15��16minʱƽ����Ӧ���ʵĴ�С��v(5��6)__v(15��16)(����<������>����������)��ԭ����__��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com