
【题目】光气(COCl2)的分解反应为:COCl2(g)![]() Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):
Cl2(g)+CO(g)ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如图所示(第10min到14min的COCl2浓度变化曲线未示出):

(1)计算反应在第8min时的平衡常数K=__;
(2)比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2)__T(8)(填“<”、“>”或“=”);
(3)若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=__mol·L-1;
(4)比较产物CO在2~3min、5~6min和12~13min时平均反应速率[平均反应速率分别以v(2~3)、v(5~6)、v(12~13)表示]的大小__;
(5)比较反应物COCl2在5~6min和15~16min时平均反应速率的大小:v(5~6)__v(15~16)(填“<”、“>”或“=”),原因是__。
【答案】0.234 < 0.031 v(5~6)>v(2~3)=v(12~13) > 在相同温度时,该反应的反应物浓度越高,反应速率越大
【解析】
本题考查![]() 图像,及平衡常数,反应速率的计算;
图像,及平衡常数,反应速率的计算;![]() 反应处于平衡状态,
反应处于平衡状态,![]() 平衡正向移动,
平衡正向移动,![]() 再次到达平衡,
再次到达平衡,![]() 移走生成物一氧化碳,使平衡再次正向进行,在
移走生成物一氧化碳,使平衡再次正向进行,在![]() 达到平衡,
达到平衡,![]() 再次改变某一条件使平衡正向移动,最终达到平衡。
再次改变某一条件使平衡正向移动,最终达到平衡。
(1)由图可知,![]() 时
时![]() 的平衡浓度为
的平衡浓度为![]() ,
,![]() 的平衡浓度为
的平衡浓度为![]()
![]() 的平衡浓度为
的平衡浓度为![]() ,故该温度下的化学平衡常数
,故该温度下的化学平衡常数![]() ;
;
故答案为:0.234;
(2)第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡正向移动,4min瞬间浓度不变,不可能为改变压强、浓度,正向移动,向吸热方向移动,故T(2) <T(8);
故答案为:<;
(3)由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算![]() ,解得
,解得![]() ;
;
故答案为:0.031;
(4)已知![]() ,结合图像可知,v(5~6)>v(2~3)=v(12~13);
,结合图像可知,v(5~6)>v(2~3)=v(12~13);
故答案为:v(5~6)>v(2~3)=v(12~13);
(5)在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小;
故答案为:> ;在相同温度时,该反应的反应物浓度越高,反应速率越大。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】如图所示:甲、乙为相互串联的两电解池。试回答:
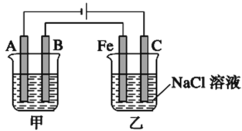
(1)乙池中Fe极电极反应式为___________,若在乙池中滴入少量酚酞试液,开始电解一段时间,铁极附近呈_________色。
(2)甲池若为用电解原理精炼铜(假设粗铜的组成是均匀的,且比其活泼和不活泼的成分均存在)的装置,则A电极名称为_____极,电极反应式为____________,电解质溶液可以是______;通电一段时间后,A极增重12.8g,则甲池溶液原溶质的浓度______(填“增大”、“减小”、“不变”或“无法确定”),乙池C(石墨)极放出气体在标准状况下的体积为________,若此时,乙池剩余溶液为25℃,体积为400 mL,则溶液的pH=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池是现代高性能电池的代表,高性能的电极材料与物质结构密切相关。
(l) LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为____。P、O、S的电负性从大到小的顺序为______________
(2)通常在电极材料表面进行“碳”包覆处理以增强其导电性。抗坏血酸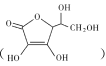 常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
常被用作碳包覆的碳源,其易溶于水的原因是 ___,抗坏血酸中碳原子的杂化方式为 ___,1mol抗坏血酸中手性碳原子的数目为______
(3) Li+过度脱出易导致锂电池结构坍塌产生O2而爆炸,实验证实O2因具有单电子而成为顺磁性分子,下列结构式(黑点代表电子)中最有可能代表O2分子结构的是____(填标号)。
A. ![]()
B. 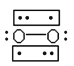
C. ![]()
D. 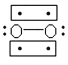
(4)目前最常用的电极材料有锂钴复合氧化物和石墨。
①锂钴复合氧化物中Li、Co、O分别形成了六边层状结构(图a),按照Li-O-Co-O-Li–O-Co-O- Li--顺序排列,则该化合物的化学式为____,Co3+的价层电子排布式为_____。
②石墨晶胞(图b)层间距为d pm,C—C键长为a pm,石墨晶体的密度为p g/cm3,列式表示阿伏加德罗常数为____mol-l。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X含有K+、Mg2+、Fe3+、Al3+、Fe2+、Cl-、CO32-、OH-、SiO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.2mol·L-1(不考虑水的电离及离子的水解)。为确定该溶液中含有的离子,现进行了如下的操作:

下列说法正确的是
A.无色气体可能是NO和CO2的混合物
B.原溶液可能存在Fe3+
C.溶液X中所含离子种类共有4种
D.另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及到H、O、Cl、N四种元素形成的六种微粒,N2、H2O、ClO-、H+、NH4+、Cl-,其中N2的物质的量随时间变化的曲线如图所示:

完成下列填空
(1)氧原子最外层电子的轨道表示式为__________,该化学用语不能表达出氧原子最外层电子的______(填序号)。
a. 电子层 b. 电子亚层 c. 所有电子云的伸展方向 d.自旋状态
(2)四种元素中有两种元素处于同周期,下列叙述中不能说明这两种元素非金属性递变规律的事实是___________。
a.最高价氧化物对应水化物的酸性 b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价 d.气态氢化物的沸点
(3)由这四种元素中任意3种所形成的常见化合物中属于离子晶体的有_________(填化学式,写出一个即可),该化合物的水溶液显____(填“酸性”、“碱性”或“中性”)。
(4)写出该离子反应的方程式_______________,若将该反应设计成原电池,则N2应该在___________(填“正极”或“负极”)附近逸出。
(5)已知亚硝酸(HNO2)的酸性与醋酸相当,很不稳定,通常在室温下立即分解。则:
①酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I- 被氧化为I2时,产物中含氮的物质为______(填化学式)。
②要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质不适合使用是________(填序号)。
a. 稀硫酸 b. 二氧化碳 c. 二氧化硫 d. 磷酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁、明矾可用作净水剂。某课题组拟以废弃的铝铁合金为原料制备聚合硫酸铁和明矾,设计化工流程如下:
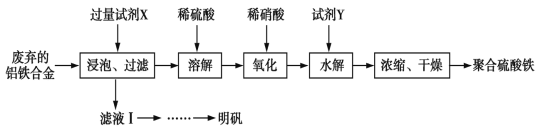
已知:聚合硫酸铁能溶于水,微溶于乙醇,其化学式可表示为[Fe2(OH)x(SO4)y]n。
(1)在聚合硫酸铁中,x、y之间的关系是_______________。试剂X中溶质的化学式为______。
(2)写出上述流程图中的“氧化”的离子方程式:______________该设计存在缺陷,请提出改进意见;________
(3)加入试剂Y的目的是为了调节溶液的pH,若Y为氧化物,写出调节pH的离子方程式:_____
(4)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2 的混合溶液中加入碱液,要使Fe3+ 刚好完全沉淀的pH为____,而Mg2+刚好开始要沉淀的pH为__________。(已知lg 2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 L 1mol·L-1的NH4Fe(SO4)2溶液中,Fe3+数目与SO42-数目之比为1:2
B.标况下,22.4 L NO2与足量水反应生成0.5NA个NO分子
C.1 mol石墨和金刚石的混合物中,含碳碳键数目为4NA
D.K37ClO3+6H35Cl=3Cl2↑+KCl+3H2O若该反应转移5NA个电子,则生成212 g Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol·L-1NaOH溶液滴定20.00 mL 0.1000 mol·L-1HA溶液,滴定曲线如图。下列说法不正确的是
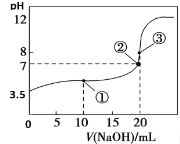
A. 常温下,HA电离常数为1.0×10-6
B. 点②所示溶液中:c(Na+)< c(HA)+c(A-)
C. 点③所示溶液中:c(Na+)> c(A-)> c(OH-)>c(H+)
D. 从点①到点③的滴定过程中,水的电离程度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)作为一种化工原料,可广泛用于新型电池材料、感光材料的生产。以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:

(1)如图是反应温度、加料时间及分散剂的质量分数对草酸亚铁纯度的影响:
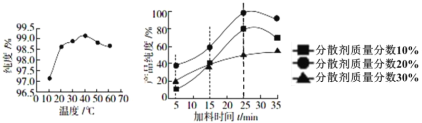
从图象可知,制备电池级草酸亚铁晶体的最佳实验条件是_____________________________
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式______________________
(3)滤渣2中含有TiOSO4,进行热水解可以生成不溶于水的TiO2·H2O,该反应的化学方程式为___________________________。
(4)流程图中“滤液”经处理后得到一种化肥,其化学式为_________。“一系列操作”指___________。
(5)草酸亚铁固体纯度的测定
①准确称取m g草酸亚铁固体样品,溶于30 mL 2 mol·L-1H2SO4溶液中,在60~80℃水浴加热,用100 mL容量瓶配成100.00 mL溶液。
②取20.00 mL,用KMnO4标准溶液(浓度为c mol·L-1)消耗V1mL。
③向滴定后的溶液中加入适量锌粉,用试剂x检验Fe3+至极微量,过滤,洗涤,洗涤液并入滤液中。
④继续用KMnO4标准溶液(浓度为c mol·L-1)滴定至终点,消耗V2mL。
在②中溶液中发生2MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O,还有另一氧化还原反应,写出其离子方程式_____________,步骤③中检验其中微量的Fe3+的试剂x名称是_________溶液,固体样品的纯度为_____________(用含c、V1、V2的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com