
ЁОЬтФПЁПяЎРызгЕчГиЪЧЯжДњИпадФмЕчГиЕФДњБэЃЌИпадФмЕФЕчМЋВФСЯгыЮяжЪНсЙЙУмЧаЯрЙиЁЃ
(l) LiFePO4вђОпгаСМКУЕФНсЙЙЮШЖЈадЖјГЩЮЊаТвЛДње§МЋВФСЯЃЌетгыPO43-ЕФНсЙЙУмЧаЯрЙиЃЌPO43-ЕФСЂЬхЙЙаЭЮЊ____ЁЃPЁЂOЁЂSЕФЕчИКадДгДѓЕНаЁЕФЫГађЮЊ______________
(2)ЭЈГЃдкЕчМЋВФСЯБэУцНјааЁАЬМЁБАќИВДІРэвддіЧПЦфЕМЕчадЁЃПЙЛЕбЊЫс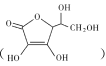 ГЃБЛгУзїЬМАќИВЕФЬМдДЃЌЦфвзШмгкЫЎЕФдвђЪЧ ___ЃЌПЙЛЕбЊЫсжаЬМдзгЕФдгЛЏЗНЪНЮЊ ___ЃЌ1molПЙЛЕбЊЫсжаЪжадЬМдзгЕФЪ§ФПЮЊ______
ГЃБЛгУзїЬМАќИВЕФЬМдДЃЌЦфвзШмгкЫЎЕФдвђЪЧ ___ЃЌПЙЛЕбЊЫсжаЬМдзгЕФдгЛЏЗНЪНЮЊ ___ЃЌ1molПЙЛЕбЊЫсжаЪжадЬМдзгЕФЪ§ФПЮЊ______
(3) Li+Й§ЖШЭбГівзЕМжТяЎЕчГиНсЙЙЬЎЫњВњЩњO2ЖјБЌеЈЃЌЪЕбщжЄЪЕO2вђОпгаЕЅЕчзгЖјГЩЮЊЫГДХадЗжзгЃЌЯТСаНсЙЙЪНЃЈКкЕуДњБэЕчзгЃЉжазюгаПЩФмДњБэO2ЗжзгНсЙЙЕФЪЧ____ЃЈЬюБъКХЃЉЁЃ
A. ![]()
B. 
C. ![]()
D. 
(4)ФПЧАзюГЃгУЕФЕчМЋВФСЯгаяЎюмИДКЯбѕЛЏЮяКЭЪЏФЋЁЃ
ЂйяЎюмИДКЯбѕЛЏЮяжаLiЁЂCoЁЂOЗжБ№аЮГЩСЫСљБпВузДНсЙЙЃЈЭМaЃЉЃЌАДееLi-O-Co-O-LiЈCO-Co-O- Li--ЫГађХХСаЃЌдђИУЛЏКЯЮяЕФЛЏбЇЪНЮЊ____ЃЌCo3+ЕФМлВуЕчзгХХВМЪНЮЊ_____ЁЃ
ЂкЪЏФЋОЇАћЃЈЭМbЃЉВуМфОрЮЊd pmЃЌCЁЊCМќГЄЮЊa pmЃЌЪЏФЋОЇЬхЕФУмЖШЮЊp g/cm3ЃЌСаЪНБэЪОАЂЗќМгЕТТоГЃЪ§ЮЊ____mol-lЁЃ

ЁОД№АИЁПе§ЫФУцЬх O>S>P ЗжзгжаКЌгаЖрИієЧЛљЃЌПЩгыЫЎЗжзгМфаЮГЩЧтМќ sp2ЁЂsp3 2NA B LiCoO2 3d6 ![]()
ЁОНтЮіЁП
(l) ИљОнМлВуЕчзгЖдЛЅГтРэТлЃЌМЦЫуСзЫсИљРызгЕФМлЕчзгЖдЪ§ЃЌевГіPO43-ПеМфЙЙаЭЃЌPЁЂOЁЂSЕФЕчИКадДгДѓЕНаЁЕФЫГађАДЗЧН№ЪєадЧПШѕКЭЕчИКадДѓаЁжЎМфЕФЙиЯЕРДЛиД№ЃЛ
(2)ПЙЛЕбЊЫс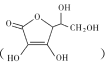 взШмгкЫЎЕФдвђДггАЯьШмНтадЕФвђЫиЁЊЁЊКЌєЧЛљМАЦфгыЫЎЕФзїгУРДЗжЮіЃЌПЙЛЕбЊЫсжаЬМдзгЕФдгЛЏЗНЪНДгЬМЬММќНЧЖШЗжЮіЃЌ1molПЙЛЕбЊЫсжаЪжадЬМдзгЕФЪ§ФПНсКЯЖЈвхКЭЭМЪОНсЙЙХаЖЯЃЛ
взШмгкЫЎЕФдвђДггАЯьШмНтадЕФвђЫиЁЊЁЊКЌєЧЛљМАЦфгыЫЎЕФзїгУРДЗжЮіЃЌПЙЛЕбЊЫсжаЬМдзгЕФдгЛЏЗНЪНДгЬМЬММќНЧЖШЗжЮіЃЌ1molПЙЛЕбЊЫсжаЪжадЬМдзгЕФЪ§ФПНсКЯЖЈвхКЭЭМЪОНсЙЙХаЖЯЃЛ
(3)НсКЯаХЯЂКЭЪОвтЭМбЁдёХаЖЯЃЛ
(4)НсКЯЂйяЎюмИДКЯбѕЛЏЮяжаLiЁЂCoЁЂOЗжБ№аЮГЩСЫСљБпВузДНсЙЙЃЈЭМaЃЉЃЌгУОљЬЏЗЈМЦЫуОЇАћФкЕФдзгЪ§ЃЌЧѓИУЛЏКЯЮяЕФЛЏбЇЪНЃЌюмЕФдзгађЪ§ЮЊ27ЃЌдђАДЕчзгХХВМЙцТЩПЩаДCo3+ЕФМлВуЕчзгХХВМЪНЃЛ
ЂквбжЊЪЏФЋОЇАћЃЈЭМbЃЉВуМфОрЮЊd pmЃЌCЁЊCМќГЄЮЊa pmЃЌАДОЇАћЕФУмЖШЕШгкОЇЬхЕФУмЖШЮЊp g/cm3ЃЌСаЪНЧѓАЂЗќМгЕТТоГЃЪ§ЃЛ
(l) PO43-жаPдзгМлВуЕчзгЖдИіЪ§![]() ЧвВЛКЌЙТЕчзгЖдЃЌИљОнМлВуЕчзгЖдЛЅГтРэТлХаЖЯПеМфЙЙаЭЮЊе§ЫФУцЬхНсЙЙЃЛ
ЧвВЛКЌЙТЕчзгЖдЃЌИљОнМлВуЕчзгЖдЛЅГтРэТлХаЖЯПеМфЙЙаЭЮЊе§ЫФУцЬхНсЙЙЃЛ
Д№АИЮЊЃКе§ЫФУцЬхЃЛ
дЊЫиЕФЗЧН№ЪєаддНЧПЃЌЦфЕчИКаддНДѓЃЌдђЕчИКадO>S>PЃЛ
Д№АИЮЊЃКO>S>PЃЛ
(2)ПЙЛЕбЊЫс ЬМдзгЪ§ФПЯрЖдНЯЩйЃЌЕЋЗжзгФкКЌ4ИієЧЛљЃЌПЩгыЫЎЗжзгМфаЮГЩЧтМќЃЌвђДЫЫќвзШмгкЫЎЃЛ
ЬМдзгЪ§ФПЯрЖдНЯЩйЃЌЕЋЗжзгФкКЌ4ИієЧЛљЃЌПЩгыЫЎЗжзгМфаЮГЩЧтМќЃЌвђДЫЫќвзШмгкЫЎЃЛ
Д№АИЮЊЃКЗжзгжаКЌгаЖрИієЧЛљЃЌПЩгыЫЎЗжзгМфаЮГЩЧтМќЃЛ
ЗжзгФкгаЬМЬМЕЅМќЁЂЖдгІЬМдзгsp3дгЛЏЗНЪНЃЌвВгаЬМЬМЫЋМќЃЌЖдгІЬМдзгsp2дгЛЏЗНЪНЃЛ
Д№АИЮЊЃКsp2ЁЂsp3ЃЛ
гыЫФИіВЛЭЌЕФдзгЛђдзгЭХЯрСЌЕФЬМдзгГЦЮЊЪжадЬМдзгЃЌгЩЭМжЊЃЌ1ИіПЙЛЕбЊЫсЗжзгжаКЌ2ИіЪжадЬМдзгЃЌдђ1molПЙЛЕбЊЫсжаЪжадЬМдзгЕФЪ§ФПЮЊ2NAЃЛ
Д№АИЮЊЃК2NAЃЛ
(3)НсКЯаХЯЂЃКO2вђОпгаЕЅЕчзгЖјГЩЮЊЫГДХадЗжзгЃЌДгЪОвтЭМжЊBНсЙЙжаЛЏбЇМќга3ЕчзгЃЌBгаЕЅЕчзгЃЌBТњзуЃЛ
Д№АИЮЊЃКBЃЛ
(4) яЎюмИДКЯбѕЛЏЮяжаLiЁЂCoЁЂOЗжБ№аЮГЩСЫСљБпВузДНсЙЙЃЈЭМaЃЉЃЌећИіСљРтжљНсЙЙжаЃКLiИіЪ§ЮЊЃК![]() ИіЃЌCoИіЪ§ЮЊЃК
ИіЃЌCoИіЪ§ЮЊЃК![]() ЃЌOИіЪ§ЮЊЃК
ЃЌOИіЪ§ЮЊЃК![]() дђЃЌLiЁЂCoКЭOИіЪ§БШЮЊ1ЃК1ЃК2ЃЌЛЏбЇЪНЮЊLiCoO2ЃЛ
дђЃЌLiЁЂCoКЭOИіЪ§БШЮЊ1ЃК1ЃК2ЃЌЛЏбЇЪНЮЊLiCoO2ЃЛ
Д№АИЮЊЃКLiCoO2ЃЛ
юмЕФдзгађЪ§ЮЊ27ЃЌCo3+га24ИіЕчзгЃЌЕчзгХХВМЪНЮЊ[Ar] 3d6ЃЌЦфМлВуЕчзгХХВМЪНЮЊ3d6ЃЛ
Д№АИЮЊЃК3d6ЃЛ
ЪЏФЋОЇАћжаЬМдзгЪ§ФП=![]() ЃЌЙЪОЇАћЕФжЪСП=
ЃЌЙЪОЇАћЕФжЪСП=![]() ЃЌВуФкЃЈЦНааЫФБпаЮЃЉCЁЊCМќГЄЮЊa pm=
ЃЌВуФкЃЈЦНааЫФБпаЮЃЉCЁЊCМќГЄЮЊa pm=![]() ЃЌЕзУцЕФБпГЄЮЊ
ЃЌЕзУцЕФБпГЄЮЊ![]() ЃЌЕзУцЩЯЕФИпЮЊ
ЃЌЕзУцЩЯЕФИпЮЊ![]() ЕзУцЕФБпГЄ=
ЕзУцЕФБпГЄ=![]() ЃЌВуМфОрЮЊd pmЃЌдђОЇАћЕФЬхЛ§=
ЃЌВуМфОрЮЊd pmЃЌдђОЇАћЕФЬхЛ§=![]() ЁС
ЁС![]() ЁС
ЁС![]() =
=![]() ЃЌдђИУОЇАћЕФУмЖШ
ЃЌдђИУОЇАћЕФУмЖШ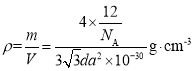 ЃЌдђNA=
ЃЌдђNA=![]() ЃЛ
ЃЛ
Д№АИЮЊЃК ![]() ЁЃ
ЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШчЭМЗжБ№БэЪОКьСзЁЂАзСзШМЩеЪБЕФФмСПБфЛЏЃЌгаЙиЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.АзСзБШКьСзЮШЖЈ
B.АзСзШМЩеВњЮяБШКьСзШМЩеВњЮяЮШЖЈ
C.1mol АзСззЊБфЮЊКьСзЗХГі 2244.7kJ ЕФШШСП
D.КьСзШМЩеЕФШШЛЏбЇЗНГЬЪНЃК4P(s)+5O2(g)ЁњP4O10(s)+2954kJ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙигкФГЫсЕФЫсЪНбЮNaHYЕФЫЎШмвКЕФЯТСаа№ЪіжаЃЌе§ШЗЕФЪЧ
A. ИУЫсЪНбЮЕФЫЎШмвКвЛЖЈЯдЫсад
B. дкИУбЮШмвКжаЃЌРызгХЈЖШЮЊЃКc(Na+)ЃОc(Y2-)ЃОc(HY-)ЃОc(OH-)ЃОc(H+)
C. ШєHY-ФмЫЎНтЃЌЫЎНтЗНГЬЪНЮЊЃКHY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. ШєHY-ФмЕчРыЃЌЕчРыЗНГЬЪНЮЊЃКHY-+H2O![]() Y2-+H3O+
Y2-+H3O+
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкЪвЮТЯТЃЌЯТСаЮхжжШмвКЃКЂй0.1 mol/L NH4ClЃЛЂк0.1 mol/L CH3COONH4ЃЛЂл0.1 mol/L NH4HSO4ЃЛЂм0.1 mol/L NH3ЁЄH2OКЭ0.1 mol/L NH4ClЛьКЯвКЃЛЂн0.1 mol/L NH3ЁЄH2OЃЌЧыИљОнвЊЧѓЬюаДЯТСаПеАзЃК
(1)ШмвКЂйГЪ__________ад(ЬюЁАЫсЁБЁЂЁАМюЁБЛђЁАжаЁБ)ЃЌЦфдвђЪЧ__________ЁЃ(гУРызгЗНГЬЪНБэЪО)
(2)БШНЯШмвКЂйЁЂЂкЁЂЂлЁЂЂнжаc(NH4+)ЕФгЩДѓЕНаЁЕФЫГађ__________ЁЃ
(3)дкШмвКЂмжаЃЌ__________РызгЕФХЈЖШЮЊ0.1 mol/LЃЛNH3ЁЄH2OКЭ__________РызгЕФЮяжЪЕФСПХЈЖШжЎКЭЮЊ0.2 mol/LЁЃ
(4)ЪвЮТЯТЃЌВтЕУШмвКЂкЕФpH=7ЃЌдђЫЕУїCH3COO-ЕФЫЎНтГЬЖШ__________(ЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ)NH4+ЕФЫЎНтГЬЖШЃЌCH3COO-гыNH4+ХЈЖШЕФДѓаЁЙиЯЕЪЧЃКc(CH3COO-)_______c(NH4+)(ЬюЁА>ЁБЁЂЁА<ЁБЛђЁА=ЁБ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЪвЮТЯТЃЌЯђ20mLХЈЖШОљЮЊ0.1mol/LЕФNaOHКЭMOHШмвКжаЗжБ№ЕЮМг0. 1mol/LбЮЫсЃЌШмвКЕФpHЫцбЮЫсЬхЛ§БфЛЏШчЭМЫљЪОЁЃЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ( )
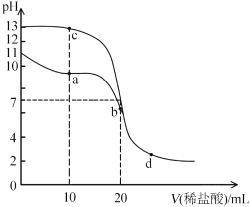
A.MOHЕФЕчРыГЃЪ§дМЮЊ1ЁСl0-5B.aЕуШмвКжаДцдк![]()
C.bЕуКЭcЕуШмвКЛьКЯКѓЯдМюадD.ЫЎЕФЕчРыГЬЖШЃКd>b>a
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП5ЉЖўМзбѕЛљБНЗгЪЧживЊЕФгаЛњКЯГЩжаМфЬхЃЌПЩгУгкЬьШЛЮяжЪАзФћУЪЫиЕФКЯГЩЃЌвЛжжвдМфБНШ§ЗгЮЊдСЯЕФКЯГЩЗДгІШчЯТЃК

МзДМЁЂввУбКЭ3ЃЌ5ЉЖўМзбѕЛљБНЗгЕФВПЗжЮяРэаджЪМћЯТБэЃК

ЃЈ1ЃЉЗДгІНсЪјКѓЃЌЯШЗжРыГіМзДМЃЌдйМгШыввУбНјаанЭШЁЃЌЂйЗжРыГіМзДМЕФВйзїЪЧЕФ______ЃЛЂкнЭШЁгУЕНЕФЗжвКТЉЖЗЪЙгУЧАаш__________________ВЂЯДОЛЃЌЗжвКЪБгаЛњВудкЗжвКТЉЖЗЕФ________ЬюЃЈЁАЩЯЁБЛђЁАЯТЁБЃЉВуЃЛ
ЃЈ2ЃЉЗжРыЕУЕНЕФгаЛњВувРДЮгУБЅКЭNaHCO3ШмвКЁЂБЅКЭЪГбЮЫЎЁЂЩйСПеєСѓЫЎНјааЯДЕгЃЎгУБЅКЭNaHCO3ШмвКЯДЕгЕФФПЕФЪЧ__ЃЌгУБЅКЭЪГбЮЫЎЯДЕгЕФФПЕФЪЧ______ЃЛ
ЃЈ3ЃЉЯДЕгЭъГЩКѓЃЌЭЈЙ§вдЯТВйзїЗжРыЁЂЬсДПВњЮяЃЌе§ШЗЕФВйзїЫГађЪЧ__ЃЈЬюзжФИЃЉЃЛ
aЃЎеєСѓГ§ШЅввУб bЃЎжиНсОЇ cЃЎЙ§ТЫГ§ШЅИЩдяМС dЃЎМгШыЮоЫЎCaCl2ИЩдя
ЃЈ4ЃЉЙЬвКЗжРыГЃВЩгУМѕбЙЙ§ТЫЃЎЮЊСЫЗРжЙЕЙЮќЃЌМѕбЙЙ§ТЫЭъГЩКѓгІЯШ________________ЃЌдй______ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇбЇЯАаЁзщНјааШчЯТЪЕбщЁЃ
ЁОЬНОПЗДгІЫйТЪЕФгАЯьвђЫиЁПЩшМЦСЫШчЯТЕФЗНАИВЂМЧТМЪЕбщНсЙћ(КіТдШмвКЛьКЯЬхЛ§Бф ЛЏ)ЁЃЯобЁЪдМСКЭвЧЦїЃК0.20mol/LH2C2O4 ШмвКЁЂ0.010mol/L KMnO4 ШмвКЃЈЫсадЃЉЁЂеєСѓЫЎЁЂ ЪдЙмЁЂСПЭВЁЂУыБэЁЂКуЮТЫЎдЁВл
ЃЈ1ЃЉЩЯЪіЪЕбщЂйЂкЪЧЬНОП ЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЛШєЩЯЪіЪЕбщЂкЂлЪЧЬНОПХЈЖШЖдЛЏбЇЗДгІЫйТЪЕФгАЯьЃЌдђ a ЮЊ ЃЛввЪЧЪЕбщашвЊВтСПЕФЮяРэСПЃЌдђБэ ИёжаЁАввЁБгІЬюаД ЁЃ
ЁОВтЖЈ H2C2O4ЁЄxH2O жа x жЕЁП вбжЊЃКMЃЈH2C2O4ЃЉ=90g/mol
ГЦШЁ 1.260 g ДПВнЫсОЇЬхЃЌНЋЦфЫсжЦГЩ 100.00 mL ЫЎШмвКЮЊД§ВтвКЁЃ
ЂкШЁ 25.00 mL Д§ВтвКЗХШызЖаЮЦПжаЃЌдйМгШыЪЪЕФЯЁ H2SO4
ЂлгУХЈЖШЮЊ 0.05000 molЁЄL-1 ЕФ KMnO БъзМШмвКНјааЕЮЖЈЃЛ
ЃЈ2ЃЉЧыаДГігыЕЮЖЈгаЙиЗДгІЕФРызгЗНГЬЪН
ЃЈ3ЃЉФГбЇЩњЕФЕЮЖЈЗНЪНЃЈМаГжВПЗжТдШЅЃЉШчЯТЃЌзюКЯРэЕФЪЧ ЃЈбЁЬю aЁЂbЃЉЁЃ


ЃЈ4ЃЉгЩгвЭМПЩжЊЯћКФ KMnO4 ШмвКЬхЛ§ЮЊ mLЃЛ
ЃЈ5ЃЉЕЮЖЈЙ§ГЬжаблОІгІзЂЪг_________________ЃЛ
ЃЈ6ЃЉЭЈЙ§ЩЯЪіЪ§ОнЃЌЧѓЕУ x= ЁЃвдБъзМ KMnO4 ШмвКЕЮЖЈбљЦЗШмвКЕФХЈЖШЃЌЮДгУ БъзМ KMnO4 ШмвКШѓЯДЕЮЖЈЙмЃЌв§Ц№ЪЕбщНсЙћ ЃЈЦЋДѓЁЂЦЋаЁЛђУЛгагАЯьЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЙтЦј(COCl2)ЕФЗжНтЗДгІЮЊЃКCOCl2(g)![]() Cl2(g)ЃЋCO(g)ІЄHЃНЃЋ108kJЁЄmol-1ЁЃЗДгІЬхЯЕДяЕНЦНКтКѓЃЌИїЮяжЪЕФХЈЖШдкВЛЭЌЬѕМўЯТЕФБфЛЏзДПіШчЭМЫљЪО(Ек10minЕН14minЕФCOCl2ХЈЖШБфЛЏЧњЯпЮДЪОГі)ЃК
Cl2(g)ЃЋCO(g)ІЄHЃНЃЋ108kJЁЄmol-1ЁЃЗДгІЬхЯЕДяЕНЦНКтКѓЃЌИїЮяжЪЕФХЈЖШдкВЛЭЌЬѕМўЯТЕФБфЛЏзДПіШчЭМЫљЪО(Ек10minЕН14minЕФCOCl2ХЈЖШБфЛЏЧњЯпЮДЪОГі)ЃК

ЃЈ1ЃЉМЦЫуЗДгІдкЕк8minЪБЕФЦНКтГЃЪ§K=__ЃЛ
ЃЈ2ЃЉБШНЯЕк2minЗДгІЮТЖШT(2)гыЕк8minЗДгІЮТЖШT(8)ЕФИпЕЭЃКT(2)__T(8)(ЬюЁА<ЁБЁЂЁА>ЁБЛђЁАЃНЁБ)ЃЛ
ЃЈ3ЃЉШє12minЪБЗДгІгкЮТЖШT(8)ЯТжиаТДяЕНЦНКтЃЌдђДЫЪБc(COCl2)=__molЁЄL-1ЃЛ
ЃЈ4ЃЉБШНЯВњЮяCOдк2ЁЋ3minЁЂ5ЁЋ6minКЭ12ЁЋ13minЪБЦНОљЗДгІЫйТЪ[ЦНОљЗДгІЫйТЪЗжБ№вдv(2ЁЋ3)ЁЂv(5ЁЋ6)ЁЂv(12ЁЋ13)БэЪО]ЕФДѓаЁ__ЃЛ
ЃЈ5ЃЉБШНЯЗДгІЮяCOCl2дк5ЁЋ6minКЭ15ЁЋ16minЪБЦНОљЗДгІЫйТЪЕФДѓаЁЃКv(5ЁЋ6)__v(15ЁЋ16)(ЬюЁА<ЁБЁЂЁА>ЁБЛђЁАЃНЁБ)ЃЌдвђЪЧ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЩњВњЗћКЯШЫРрашвЊЕФЬиЖЈадФмЕФЮяжЪЪЧЛЏбЇЗўЮёгкШЫРрЕФд№ШЮЁЃНтШШеђЭДвЉЫЎбюЫсИФНјЮЊАЂЫОЦЅСжЁЂЛКЪЭАЂЫОЦЅСжЁЂБДХЕѕЅОЭЪЧзюКУЕФЪЕР§ЁЃЯТЭМБэЪОетШ§жжвЉЮяЕФКЯГЩЃК

(1)ЗДгІЂйЕФЬѕМўЪЧ____________ЃЛЮяжЪBКЌгаЕФЙйФмЭХУћГЦЪЧ________________
(2)вбжЊввЫсєћЪЧ2ЗжзгввЫсЭбШЅ1ЗжзгЫЎЕФВњЮяЃЌаДГіMЕФНсЙЙМђЪН__________
(3)ЗДгІЂлЕФРраЭ____________ЃЌаДГіИУЗДгІЂмЕФвЛжжИБВњЮяЕФНсЙЙМђЪН________
(4)ЫЎбюЫсгызуСПNa2CO3ШмвКФмЗЂЩњЗДгІЃЌаДГіЛЏбЇЗНГЬЪН____________________
(5)1molАЂЫОЦЅСжКЭ1molЛКЪЭГЄаЇАЂЫОЦЅСжгыNaOHШмвКГфЗжЗДгІЃЌзюЖрЯћКФNaOHЕФЮяжЪЕФСПЗжБ№ЪЧ_________ЁЂ___________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com