
【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验 | 实验III | 实验IV | |
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:
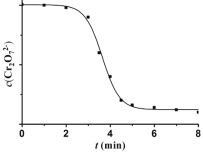
臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。
【答案】H2C2O4![]() HC2O4-+H+ 、HC2O4-
HC2O4-+H+ 、HC2O4-![]() C2O42-+H+ 5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O 排除实验II中MnO2直接还原重铬酸钾的可能 Mn2+可加快草酸与重铬酸钾的反应 0.1mol/LH2C2O4溶液(调至pH=2) 上清液为紫色 2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/L K2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体(或15.1mgMnSO4),6min后溶液橙色变浅 氧化剂种类、溶液pH、是否有催化剂
C2O42-+H+ 5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O 排除实验II中MnO2直接还原重铬酸钾的可能 Mn2+可加快草酸与重铬酸钾的反应 0.1mol/LH2C2O4溶液(调至pH=2) 上清液为紫色 2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/L K2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体(或15.1mgMnSO4),6min后溶液橙色变浅 氧化剂种类、溶液pH、是否有催化剂
【解析】
(1)H2C2O4是二元弱酸,分步电离;
(2)酸性条件下,KMnO4最终被还原为Mn2+,草酸被氧化为二氧化碳;
(3)实验IV与实验II、III区别是没有草酸;
(4)分析曲线可知,开始时Cr2O72- 浓度变化缓慢,一段时间后变化迅速;
①由实验结论出发即可快速解题;
②由控制变量法可知,保持其他变量不变,将MnO2换成等物质的量的MnSO4固体即可;
(5)注意实验的变量有:氧化剂种类、溶液pH、是否有催化剂。
(1)H2C2O4是二元弱酸,分步电离,用可逆符号,则H2C2O4溶于水的电离方程式为H2C2O4![]() HC2O4-+H+ 、HC2O4-
HC2O4-+H+ 、HC2O4-![]() C2O42-+H+;
C2O42-+H+;
(2)实验I试管a中,酸性条件下,KMnO4最终被还原为Mn2+,草酸被氧化为二氧化碳,则该反应的离子方程式为5H2C2O4+6H++2MnO4-=10CO2↑+2Mn2++8H2O;
(3)实验IV与实验II、III区别是没有草酸,则实验IV的目的是:排除实验II中MnO2直接还原重铬酸钾的可能;
(4)分析曲线可知,开始时Cr2O72- 浓度变化缓慢,一段时间后变化迅速,则可能是过程i.MnO2与H2C2O4反应生成了Mn2+。过程ii.Mn2+可加快草酸与重铬酸钾的反应;
①将0.0001molMnO2加入到6mL 0.1mol/LH2C2O4溶液(调至pH=2)中,固体完全溶解,则说明MnO2与H2C2O4反应生成了Mn2+;从中取出少量溶液(含Mn2+),加入过量PbO2固体,充分反应后静置,观察到上清液为紫色,则说明溶液中Mn2+能被PbO2氧化为MnO4-,MnO4-显紫色;
②设计实验方案证实过程ii成立,由控制变量法可知,保持其他变量不变,将MnO2换成等物质的量的MnSO4固体即可,即实验方案是2mL、0.3mol/LH2C2O4溶液与4mL0.01mol/L K2Cr2O7溶液混合,调至pH=2,加入0.0001molMnSO4固体(或15.1mgMnSO4),6min后溶液橙色变浅;
(5)综合以上实验可知,变量有:氧化剂种类、溶液pH、是否有催化剂,则草酸发生氧化反应的速率与氧化剂种类、溶液pH、是否有催化剂有关。


科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是( )
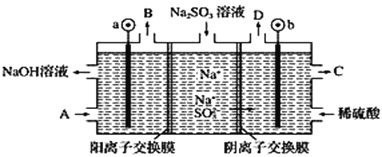
A.a电极发生还原反应,当有1 mol Na+通过阳离子交换膜时,a极生成11.2 L气体
B.若D是混合气体,则可能含有SO2、O2等成分
C.b电极上的主反应是![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C溶液是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
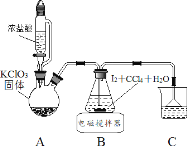
HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4 -+ Cl- |
回答下列问题:
步骤Ⅰ用 Cl2 氧化 I2 制取 HIO3
(1)装置 A 中发生反应的化学方程式_______。
(2)装置 B 中的 CCl4 可以加快反应速率,原因_______。
(3)反应结束后,获取 HIO3 溶液的操作中,所需玻璃仪器有烧杯、________和_______。
步骤Ⅱ用 KOH 中和 HIO3 制取 KIO3
(4)该中和反应的离子方程式为_______。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______(填化学式)而降低 KIO3 的产量。
(5)往中和后的溶液中加入适量_______,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2 饱和溶液过量,则无蓝色出现,原因是_______。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3 溶液的体积为 24.00 mL。则产品中 KIO3 的质量分数为_______。[M(KIO3)=214.0 g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不能用勒夏特列原理解释的事实是
A. 红棕色的NO2加压后颜色先变深后变浅
B. 氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深
C. 黄绿色的氯水光照后颜色变浅
D. 合成氨工业使用高压以提高氨的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能的优点是燃烧热值高,无污染。目前工业制氢气的一个重要反应为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH,反应过程和能量的关系如图所示:

(1)CO(g)+H2O(g)===CO2(g)+H2(g) ΔH______(填“>”“<”或“=”)0。
(2)过程Ⅱ是加入催化剂后的反应过程,则过程Ⅰ和Ⅱ的反应热________(填“相等”或“不相等”),原因是____________________________________________________________________。
(3)已知:H2(g)+![]() O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
O2(g)===H2O(g) ΔH=-242.0 kJ·mol-1
H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
则H2(g)燃烧生成H2O(l)的热化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某冶炼厂利用含ZnO的烟灰脱除工业废气中的SO2,最终得到锌盐。该厂所用烟灰的主要成分如下表所示:
主要成分 | ZnO | CaO | Fe2O3 | SiO2 | 其它 |
质量分数/% | 81 | 0.098 | 1.14 | 0.5 | ———— |
在一定条件下,将含SO2的工业废气通入烟灰浆液(烟灰和水的混合物)进行脱硫,过程中测得pH和上清液中溶解的SO2物质的量浓度[c(SO2)]随时间的变化如图所示:

(1)纯ZnO浆液的pH为6.8,但上述烟灰浆液的初始pH为7.2。在开始脱硫后3 min内(a~b段),pH迅速降至6.8,引起pH迅速变化的原因是_____(结合化学用语解释)。
(2)生产中脱除SO2效果最佳的时间范围是_____(填字母序号)。
A.20~30 min B.30~40 min C.50~60 min D.70~80 min
(3)在脱硫过程中涉及到的主要反应原理:
Ⅰ.ZnO + SO2 === ZnSO3↓
Ⅱ.ZnSO3 + SO2 + H2O === Zn(HSO3)2
①在30~40 min时,主要发生反应II,生成可溶性的Zn(HSO3)2。上清液中c(SO2)上升的原因可能是______。
②在30~80 min时,pH降低的原因可能是______(写出2点)。
③将脱硫后的混合物利用空气氧化技术处理,该过程中发生反应:2ZnSO3 + O2 === 2ZnSO4和______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
B.32.5gFeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.标准状况下,4.48L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.1NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
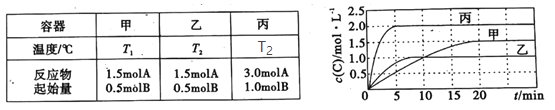
下列说法正确的是( )
A.T1< T2,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com