
����Ŀ�����г�����������A��B��C������ס��ҡ���������D��E��F��G��H��
����֮���������ת����ϵ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ�������������B�ǵؿ��к����ӵ�һ�Ľ���Ԫ�أ�C�ǵ���������������Ľ�������ش��������⣺
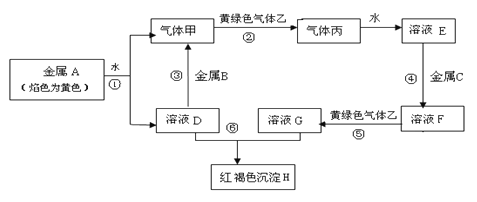
��1��д������B��������Ļ�ѧʽ �� ��
��2��д����Ӧ�ٵĻ�ѧ��Ӧ����ʽ ��
��3������H�Ļ�ѧʽΪ ��
��4������ҺG�е���KSCN��Һ��������������������������������������������
���𰸡���1��Al�� HCl ��2��2Na+2H2O=2 NaOH+H2����3��Fe(OH)3��4����Һ���ɫ
��������
�������������A��ɫΪ��ɫ��A����Ԫ�أ�����ˮ��Ӧ��������ף�����������ҺD���������ƣ�������ɫ����������������������������������Ȼ��⣩���Ȼ�������ˮ�õ���ҺE�����ᣩ�����ɫ����H���������������Խ���C�DZ�۽�����C�������������������ҺF���Ȼ����������Ȼ�����������������ҺG���Ȼ��������������ƺͽ���B��Ӧ����������B������
��1��д������B��������Ļ�ѧʽAl�� HCl��
��2������ˮ��Ӧ�Ļ�ѧ��Ӧ����ʽ2Na+2H2O=2NaOH+H2����
��3������H�Ļ�ѧʽΪFe(OH)3��
��4��Fe3+��KSCN��Һ���ɫ��G���Ȼ���������ҺG�е���KSCN��Һ����������Һ���ɫ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ݹ����ŵIJ�ͬ�������л�����з���������ţ���

��1����������_____________ ����2��±������_____________����3������_______________ ��
��4���ӣ�_____________����5��ȩ��_______________ ����6��ͪ��_____________��
��7�����_____________ ����8������_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧʵ���Ҷ�ú��ʯ(��Ҫ��Al2O3��SiO2��Fe2O3)�Ʊ��ۺ��Ȼ���{[Al2(OH)nCl6��n]m(1��n��5��m��10)�����PAC����һ�����͡���Ч���������;�ˮ��}���乤���������£�

��ش��������⣺
��1����Ũ��������20%����������IJ���������______________________________��
��2����20%������������йط�Ӧ�����ӷ���ʽΪ_____________________________��
��3������2����Ҫ�ɷ��ǣ����ʵ��֤����Ľ���(�����������):_____________________��
��4���ɳ����PACϡ��Һ��þۺ��Ȼ������壬��ʵ�������_________________���õ���PAC�ֲ�Ʒ�п��ܺ��е�����������____________��
��5���Ӳ��������ʵĽǶ������ǣ�������ҺpH���Լ��ɸ�Ϊ________(����ĸ)��
A��NaOH B��Al C����ˮ D��Al2O3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���軯����NaCN������Ҫ�Ļ���ԭ�ϣ������ڻ�ѧ�ϳɡ�ұ��ҵ�ȣ��ش��������⣺
��1�����ô����̿��������Ӧ��ȡ NaCN��ͬʱ����ˮ���ɣ�д����Ӧ�Ļ�ѧ����ʽ������������ת�Ƶķ������Ŀ______________��
��2���ִ��ɽ�������NaCN��Һ����Ȼ�����н�ȡ����ĺ�����Au����ʯ���õ� Na[Au��CN��2]������Ͻ���������Һ������п��ԭ Na[Au��CN��2]���ɽ�����ȡ����Ӧ�Ļ�ԭ������______________��
��3����ͼΪ�ú�NaCN�ķ�ˮ�ϳɻ�Ѫ����K4Fe��CN��6������Ҫ����������ͼ��

��֪��ͬ�¶����ܽ�ȣ�Na4Fe��CN��6��K4Fe��CN��6
�� ʵ������NaCN��������NaCN��Һʱ��Ӧ�Ƚ�������______________��Һ����������ˮϡ�͡�
����ת�����з�����Ӧ�Ļ�ѧ����ʽΪ______________��
������̼������Һ��ҪĿ����______________��
�ܡ����������ھ���Ϊ______________��
��4��CN -�������ˮ����Ⱦ��ijС�������·����Դ���ˮ���д�������ͼװ��ģ��绯ѧ������CN -���йؽ��������

ʵ����� | �缫��X�� | NaCl��ҺŨ����mol/L�� | ����ʯī����ͨ������ | �����ƶ�����A�� |
��1�� | Fe | 0��l | ���� | I |
��2�� | Al | 0.1 | ���� | 1.5�� |
��3�� | Fe | 0.1 | 02 | 2�� |
��4�� | Al | 0.5 | ���� | 1.6�� |
�����ҳ���ʯī��I�����������������ʣ���缫��ӦʽΪ___________��
����ʵ������绯ѧ������CN -ʱ��Ӱ�촦�����ʵ�������___________��___________���δ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
��������ͼ��ʾ������˵����ȷ���ǣ� ��

A��a��c����ķ�Ӧ���ʣ�a��c
B��a��b�����ת���ʣ�a��b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ni���������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ������ǣ� ��

A�������������缫��ӦΪFe��6e-+4H2O=FeO42-+ 8H+
B������ĤΪ�����ӽ���Ĥ����OH-���������ƶ�
C�����ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe�缫������
D��ÿ�Ƶ�1mol Na2FeO4�������Ͽ��Բ���67.2L����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M���ӵ����ģ����ͼ��ʾ����AΪԭ�Ϻϳ�B��M��·�����£�

��֪��A����Է�������Ϊ26��
��1��A������Ϊ____________ ��M�ķ���ʽΪ____________��
��2����״��B�ĺ˴Ź���������ֻ��һ�ַ壬����ʹ������Ȼ�̼��Һ��ɫ����B�Ľṹ��ʽΪ____________��
��3����1molE��ȫת��ΪFʱ����Ҫ____________ molNaOH��
��4��G�еĺ��������ŵ�������____________��д����G��Ӧ���ɸ߷��ӵĻ�ѧ��Ӧ����ʽ��____________��
��5��M��ͬ���칹���ж��֣����������������ͬ���칹�干��____________����
���ܷ���������Ӧ �����б����ұ�����һ��ȡ����������
����FeCl3��Һ������ɫ
��1mol���л����������Ʒ�Ӧ����1mol����(һ��̼ԭ����ͬʱ��������-OH���ȶ�)
������һЩ���������ɵ���Ԫȩ��д������һ�ֵĽṹ��ʽ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������Ľṹ��ͼ��ʾ�����ڿ������������ȷ����()

A����÷����廯�������ʽ��ͬ�����������༰��Ŀ����ͬ�ұ����ϵ�һ�ȴ���ֻ�����ֵ��л���Ľṹ��4��(�����ǿռ��칹)
B��������ֻ�ܼӾ۳ɸ߷��ӻ�����
C��������������5mol���������ӳɷ�Ӧ
D��1mol��������������Na2CO3��Һ��Ӧ��������3 mol CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
��1���ҹ�ij������̽���̲��зḻ�ij�����(��Ҫ�ɷ�ΪFe2O3��������SiO2������)��ú��ʯ��ʯ����������ڸõ������������������
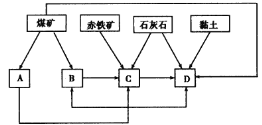
����������Ŀ������������Ľ�������Ҫ�ڸõ�����Ӧ���������������糧��ˮ�೧�ȣ��γɹ�ģ�Ĺ�ҵ��ϵ���ݴ�ȷ��ͼ����Ӧ���������ƣ�A��________��B��________��C��________��D��________��
���Գ�����Ϊԭ�ϣ�д����¯�����еõ������Ͳ���¯���Ļ�ѧ����ʽ��
__________________________________________________________��
��
��2�������ֿ��ɷ�ȩ��֬�Ͳ�����ά�Ƴɡ�
�ٷ�ȩ��֬�ɷ�ȩ�ͼ�ȩ���۶��ɣ���Ӧ�д����ȷų���Ϊ��ֹ�¶ȹ��ߣ�Ӧ���б��ӵķ�Ӧ��________�ؼ����ȩ���ҷ�Ӧ��Ӧװ��________װ�á�
�ڲ������в�����ά��������______�������־��� ���������ܣ�д�����㼴�ɣ���
�����д����Ͼ��ȹ��Է�ȩ���ϵ�������������________��
a������ b�������������֬����
c������ȼ�� d�����л��ܼ������ܽ⣬������֬
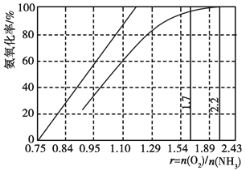
��3����ҵ����Ҫ���ð��������������ᣬ��ͼ�ǰ��������백������������������ȵĹ�ϵ������ֱ�߱�ʾ��Ӧ������ֵ�����߱�ʾ����ʵ����������������ʴﵽ100%��������r[n(O2)/n(NH3)]��________��ʵ������Ҫ��rֵά����1.7��2.2֮�䣬ԭ����___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com