
【题目】下列的说法,正确的是( )
A. 1 mol FeI2 与足量的氯气反应时转移的电子数为3 NA
B. 12 mol/L的浓硫酸50 ml 与足量的Cu加热反应,得到SO2为0.3 mol
C. 配制一定物质的量浓度溶液时,溶液的体积与容量瓶的量程一致
D. 1 mol NaHSO4固体中含离子总数为4NA
【答案】A
【解析】
A、氯气过量,则Fe2+和I-均能被氧化,每1molFeI2转移3mol电子,即3NA,故A正确。B、Cu与浓硫酸反应的方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,每反应2mol H2SO4得到1mol SO2;若12 mol/L的浓硫酸50 ml含H2SO40.6mol,若反应完全,则产生0.3mol SO2,但是随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,所以不能产生0.3mol SO2,故B错误;C、容量瓶不是度量工具,没有量程;容量瓶是用来精确配制一定物质的量浓度的溶液的仪器,容量瓶上标有温度、容量规格和一条刻度线, 配制溶液时,溶液的体积要与容量瓶的规格一致,故C错误;D、NaHSO4由Na+和HSO4-组成,1 mol NaHSO4固体中含离子总数为2NA,故D错误。故选A。
CuSO4+SO2↑+2H2O,每反应2mol H2SO4得到1mol SO2;若12 mol/L的浓硫酸50 ml含H2SO40.6mol,若反应完全,则产生0.3mol SO2,但是随着反应的进行,浓硫酸变稀,铜与稀硫酸不反应,所以不能产生0.3mol SO2,故B错误;C、容量瓶不是度量工具,没有量程;容量瓶是用来精确配制一定物质的量浓度的溶液的仪器,容量瓶上标有温度、容量规格和一条刻度线, 配制溶液时,溶液的体积要与容量瓶的规格一致,故C错误;D、NaHSO4由Na+和HSO4-组成,1 mol NaHSO4固体中含离子总数为2NA,故D错误。故选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活在某些山区的人,由于饮用的水和食物中缺碘,导致某些人患病,该病的主要症状是
A. 身体消瘦 B. 食欲旺盛 C. 血糖浓度升高 D. 甲状腺增生肿大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不正确的是( )
A.用酒精萃取碘水中的碘
B.少量金属钠保存在煤油中
C.不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭
D.配制1.00mol/L NaCl溶液时,将称好的NaCl固体放入烧杯中溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)N2H62+在碱性溶液中反应的离子方程式:_____________________________________。
(2)NH2-的电子式为__________________________,NH2-的构型为____________。
(3)写出一种与N3-是等电子体的微粒化学式___________。
(4)据报道,美国科学家卡尔·克里斯特于1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为 “盐粒炸弹”。迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形。如果5个N结合后都达到8电子结构,且含有2个N![]() N键。则“N5”分子碎片所带电荷是_______。
N键。则“N5”分子碎片所带电荷是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学一选修3: 物质结构与性质] 钾、碘、铁元素对人体的健康起到至关重要的作用,回答下列问题:
(1)基态K 原子核外有______种不同运动状态的电子,有_____种不同形状的电子云,价电子排布式是__________________。
(2)CO能与金属Fe形成Fe(CO)5,该化合物的熔点为253K,沸点为376K,其固体属于____晶体。
(3)赤铁盐(K3[Fe(CN)6])主要用于制药、电镀等工业,其煅烧分解生成KCN、(CN)2等物质。
①(CN)2中存在碳碳键,则分子中含有___个σ键,___个π键。
②KCN与盐酸作用产生HCN,则HCN中心原子C的杂化轨道类型__________________。
(4)KIO3晶体是一种性能良好的非线型光学材料,具有钙钛矿型的立体结构。
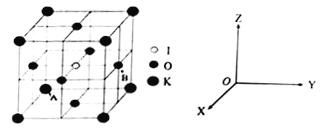
①已知A离子坐标参数为(0,0,0),则B离子的坐标参数________________。
②若KIO3晶胞参数为a纳米(nm)、阿伏伽德罗常数为NA,则该晶体密度为_____g·cm-3(列出计算式即可)。
③若碘原子处在各顶点位置,则钾离子和氧原子在晶胞中的位置分别是_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
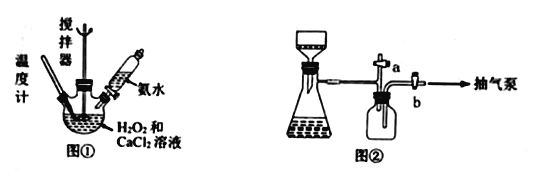
【题目】过氧化钙是一种在水产养殖中广泛使用的供氧剂。某实验研究小组用下图所示的装置制取过氧化钙并测定产品的含量。
有关过氧化钙的性质如下:
外观与性状 | 溶解性 | 稳定性 | |
过氧化钙(CaO2) | 白色结晶,无臭无味, 有潮解性 | 难溶于水,且不溶于 乙醇、乙醚 | 常温下稳定,加热至 315℃时开始分解 |
回答下列问题:
I.过氧化钙的制备
称取7.5gCaCl2·H2O,用5mL水溶解,加入25mL 30%的H2O2,边搅拌边滴加由5mL 浓NH3·H2O和20mL冷水配成的溶液,保持在0-5℃下充分反应半小时后抽滤,得到粗产品CaO2·8H2O。分别用少量冷水、乙醇洗涤该产品2~3次,在150℃下烘0.5-1h,冷却得到产品无水过氧化钙。
(1)图①盛装“CaCl2和H2O2混合液”的仪器名称______________________________。
(2)写出反应生成CaO2·8H2O的化学方程式___________________________________。
(3)抽滤后得到的晶体依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_________________________。
(4)用图②装置抽滤时,使用抽气泵抽真空前,应先关闭活塞____(填“a”或“b”)。
(5)反应温度以0~5℃为宜的原因____________________________。
II.产品中CaO2含量的测定
准确称取0.15g无水过氧化钙样品于锥形瓶中,加入50mL水和15mL2mol/LHCl,振荡使之溶解,立即用0.02mol/L的KMnO4溶液滴定至溶液呈微红色且半分钟内不褪色为止,重复实验3次,平均消耗20.00mL.KMnO4溶液。
(1)产品中CaO2的质量分数为_______________________________。
(2)若滴定后仰视读数,则测得样品中CaO2的含量___________(填“偏高”“偏低”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮有多种氢化物,其中NH3和N2H4用途最为广泛;
(1)一定条件下,在3 L密闭容器中充入4 mol N2和9 mol H2合成氨。温度为T1时,平衡时NH3的物质的量为2.4 mol,温度为T2时,平衡时NH3的物质的量为2.0mol;
已知:破坏1 molN2(g)和3 molH2(g)中的化学键消耗的总能量小于破坏2molNH3(g)中的化学键消耗的能量。
①则T1 ____________T2(填“>”、“<”或“=”);
②在T2 下,经过10min反应达到化学平衡状态,则0~10min内H2的平均反应速率v(H2)= __________,平衡时N2的转化率α(N2)=__________,平衡后若再增大氢气浓度,该反应的平衡常数__________(填“增大”、“减小”或“不变”)。
(2)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,产物无污染,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时,负极的电极反应式是__________________________;正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
(3)发射神舟飞船的长征火箭用肼(N2H4,气态)为燃料,为了提高肼(N2H4)燃烧过程中释放的能量,常用NO2作氧化剂代替O2,这两者反应生成N2和水蒸气。已知:①N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7kJ·mol-1 ②N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,写出肼和NO2完全反应的热化学方程式:______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物 1892 种,其中“烧酒”条目中写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指( )
A.分液B.渗析C.萃取D.蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com