
【题目】下图是某校化学兴趣小组同学根据实验测得的我市市区不同地区空气中SO2含量:
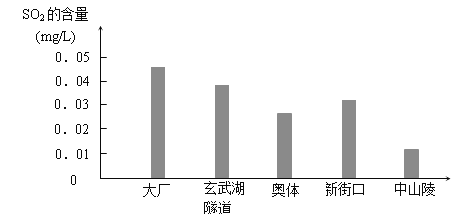
⑴大厂、玄武湖隧道SO2含量明显高于其他地区的原因是 。
⑵请你向缪瑞林市长分别提出一条降低这两个地区SO2含量的建议 。
【答案】① 大厂地区有大量的石化企业,石化企业的尾气中含有大量的SO2、玄武湖隧道是连接南京东部和城中的重要的交通枢纽,早晚高峰期交通拥堵,车速较慢,汽车在低速行驶的情况下,尾气中SO2含量较高,再加上,隧道内扩散条件不好,SO2大量聚集,含量升高。② 大厂:提高脱硫技术;玄武湖隧道:交通分流
【解析】
试题分析:(1)大厂、玄武湖隧道SO2含量明显高于其他地区的原因可能是大厂地区有大量的石化企业,石化企业的尾气中含有大量的SO2、玄武湖隧道是连接南京东部和城中的重要的交通枢纽,早晚高峰期交通拥堵,车速较慢,汽车在低速行驶的情况下,尾气中SO2含量较高,再加上,隧道内扩散条件不好,SO2大量聚集,含量升高。
(2)要想降低SO2的含量,则大厂需要提高脱硫技术;玄武湖隧道需要进行交通分流。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温下铁与浓硫酸不反应 B. 钠与氧气反应的产物与反应条件无关
C. 漂白粉暴露在空气中会变质 D. SiO2属于酸性氧化物,可与水反应得硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)![]() CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
CH3OH(g)H =a kJ·mol-1。向体积为2 L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如下左图中Ⅰ、Ⅱ、Ⅲ曲线所示:
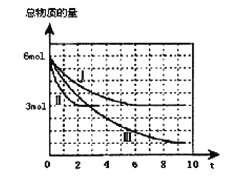
(1)能判断反应达到化学平衡状态的是 (填字母)。
A.c(CO)与c(H2)的比值保持不变
B.容器中气体压强保持不变
C.容器中气体密度保持不变
D.单位时间内有1molCO消耗的同时有1mol CH3OH生成
E.v正(H2)=2 v逆(CH3OH)
(2)①Ⅱ和Ⅰ相比,Ⅱ改变的反应条件是 。
②反应Ⅲ在9min时达到平衡,比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“>”“<”“=”),此正反应是________反应(填“放热或吸热”)。
(3)①反应Ⅰ在6 min时达到平衡,从反应开始到达到平衡时v (CH3OH) = mol/(L·min)。
②反应Ⅱ在2 min时达到平衡,计算该温度下的平衡常数K= 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1 mol CO和3 mol CH3OH后,平衡将向_________(填“正反应、逆反应和不移动”),原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A、B混合气体,在一定条件下发生反应A(g)+3B(g)![]() 2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
2C(g)。若维持温度和压强不变,当反应达到限度时容器的体积为VL,其中C气体的体积分数占10%.下列推断正确的是( )
A. 原混合气体的体积为1.1VL
B. 原混合气体的体积为1.2VL
C. 反应达到限度时,气体A消耗掉0.05 VL
D. 反应达到限度时,气体B消耗掉0.05 VL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验:
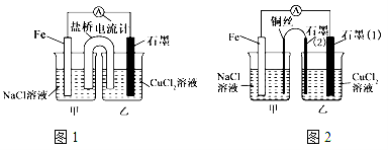
(1)如上图1为某实验小组依据氧化还原反应设计的原电池装置,若盐桥中装有饱和的KNO3溶液和琼胶制成的胶冻,则NO3-移向_____________装置(填写“甲或乙”)。其他条件不变,若将CuCl2溶液换为NH4Cl溶液,发现生成无色无味的单质气体,则石墨上电极反应式______________________。
(2)如上图2,其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则甲装置是____________(填“原电池或电解池”),乙装置中石墨(2)为 极,乙装置中与铁线相连的石墨(1)电极上发生的反应式为 。
(3)在图2乙装置中改为加入CuSO4溶液,一段时间后,若某一电极质量增重 1.28 g,则另一电极生成______________mL(标况下)气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 硫代硫酸钠与稀盐酸的反应Na2S2O3+2HCl=2NaCl+S↓+SO2↑+H2O在加热条件下反应速度加快,原因主要是( )
A.该反应是吸热反应,加热使平衡向正向移动
B.加热促使SO2逸出,使平衡向正向移动
C.加热提高了活化的S2O![]() 与H+数目,并促进S2O
与H+数目,并促进S2O![]() 与H+的碰撞,使反应加速
与H+的碰撞,使反应加速
D.加热提高了活化的Na+与Cl-数目,并促进Na+与Cl-的碰撞,使反应加速
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化还原反应,但水既不作氧化剂,又不作还原剂的是
A. Na2O+H2O=2NaOH B. 2F2+2H2O=4HF+O2
C. 3NO2+H2O=2HNO3+ NO D. 2Na+2H2O=2NaOH+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com