
 ,
, ;
;

 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:
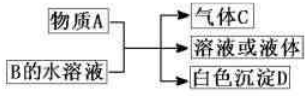
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 类别 | 周期序数 | 起止元素 | 包括元素种数 | 核外电子层数 |
| 短周期 | ||||
| 长周期 | ||||
| 不完全周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
族 周期 | ⅠA | ⅡB | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 三 | ⑦ | ⑧ | ⑨ | ⑩ | |||
| 四 | (11) | (12) | (13) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用煮沸的方法可消毒医疗器械 |
| B、用福尔马林保存生物标本 |
| C、鸡蛋白加入(NH4)2SO4溶液,可以观察到有沉淀析出 |
| D、鸡蛋白溶液里加入少量乙酸铅溶液,可以观察到有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com