
| KW |
| C(OH-) |
| 10-14 |
| 10-13 |
| 0.1×25 |
| 0.05 |
| 0.05mol/L×25mL |
| 50mL |
| 10-14 |
| 0.025 |


科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ?mol-1催化剂450℃、1MPa |
| B、450℃、1MPa下,将1mol SO2和0.5molO2置于密闭的容器中充分反应生成SO3(g),放热98.5kJ,其热化学方程式为:2SO2+O2(g)?2 SO3(g)△H=-98.5kJ?mol-1 |
| C、氯化镁溶液与氨水反应:Mg2++2OH-=Mg(OH)2↓ |
| D、用FeCl3溶液腐蚀铜箔:Cu+2Fe3+═2Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
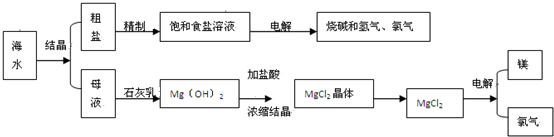
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | H | |||||
| 3 | B | C | F | G |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个氢分子与NA个氧分子的质量比为1:1 |
| B、1mol氢气的质量与NA个氢分子的质量和相等 |
| C、16g氧气中含有的氧分子数为NA |
| D、44g CO2与28g CO所含有的分子数均为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com