
【题目】新型钙钛矿型太阳能电池以其稳定、高效、便宜和便于制造等优点被科学家所青睐。这种钙钛矿型太阳能电池材料为层状结构。具体如图1所示。

(1)基态Ti原子的电子排布式为____;同周期的基态原子与其未成对电子数相同的元素还有________种。
(2)光敏钙钛矿的晶胞结构如图2所示。
①写出与CH3NH3+互为等电子体的一种分子的化学式:__,C、N、O三种元素的第一电离能由大到小的顺序为____(用元素符号表示),CH3NH3+中含有的化学键类型有____。
②光敏钙钛矿的化学式为________;每个CH3NH3+周围最近且等距离的Br-数目为__。
③若该光敏钙钛矿的摩尔质量为M g·mol-1,晶胞参数为anm,阿伏加德罗常数的值为NA,则该晶体的密度为____ g.cm-3(用含M、a、NA的代数式表示)。
(3)石墨炔的结构如图3所示,其中碳原子的轨道杂化类型是 _____ ,36 g石墨炔中含有σ键的数目为____。
【答案】1s22s22p63s23p63d24s2或[Ar]3d24s2 3 CH3CH3 N>O>C 共价键,配位键 PbCH3NH3Br3 12 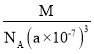 sp2、sp 3.5NA
sp2、sp 3.5NA
【解析】
(1)Ti是22号元素,根据构造原理写出基态Ti原子的电子排布式;Sc原子的未成对电子数为2,根据核外电子排布规律寻找同周期中未成对电子数为2的其它元素;
(2)①与CH3NH3+互为等电子体的一种分子可以用C原子替换N原子与1个单位正电荷,为:CH3CH3;同周期随原子序数增大,原子半径逐渐减小,第一电离能呈增大趋势,N元素的2p能级为半充满稳定状态,失去第一个电子需要的能量更高,故第一电离能最高;CH3NH3+中含有的化学键类型有共价键,配位键;
②根据均摊法,计算晶胞中CH3NH3+、Pb2+、Br-的数目,进而判断化学式;顶点的CH3NH3+与面心Br-距离最近,每个面为2个晶胞共用,故每个CH3NH3+周围最近且等距离的Br-数目为12;
③根据上一问计算的微粒数,先计算晶胞的质量g,再计算晶体密度;
(3)判断C原子的价层电子对数,从而判断其杂化方式;石墨炔的晶胞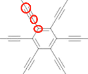 中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,再计算36g石墨炔的碳原子物质的量,进而计算含有σ键的数目。
中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,再计算36g石墨炔的碳原子物质的量,进而计算含有σ键的数目。
(1)Ti是22号元素,基态Ti原子的电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2;Sc原子的未成对电子数为2,同周期,基态原子与其未成对电子数相同,则元素原子的价电子排布式为3d84s2、4s24p2、4s24p4,共有3种;
故答案为:1s22s22p63s23p63d24s2或[Ar]3d24s2;3;
(2)①与CH3NH3+互为等电子体的一种分子可以用C原子替换N原子与1个单位正电荷,该等电子体分子为:CH3CH3;同周期随原子序数增大,原子半径逐渐减小,第一电离能呈增大趋势,N元素的2p能级为半充满稳定状态,失去第一个电子需要的能量更高,故第一电离能最高,第一电离能为:N>O>C;CH3NH3+中含有的化学键类型有共价键,配位键;
故答案为:CH3CH3;N>O>C;共价键,配位键;
②晶胞中,CH3NH3+数目为![]() ,Pb2+数目为1,Br-数目为
,Pb2+数目为1,Br-数目为![]() ,则化学式为PbCH3NH3Br;
,则化学式为PbCH3NH3Br;
顶点的CH3NH3+与面心Br-距离最近,每个面为2个晶胞共用,故每个CH3NH3+周围最近且等距离的Br-数目为12;
故答案为:PbCH3NH3Br3;12;
③晶胞质量为![]() g,晶体密度为
g,晶体密度为 ;
;
故答案为: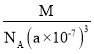 ;
;
(3)六元环上碳原子形成3个σ键,而碳碳三键中碳原子形成2个σ键,且均无孤电子对,则C原子的价层电子对数分别为3、2,分别采取sp2、sp杂化;石墨炔的晶胞 中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,36g石墨炔含有碳原子为
中,每有1个取sp2杂化的碳原子,就有2个sp杂化的碳原子,则根据均摊法,可得每3个碳原子形成2+0.5+0.5+0.5=3.5个σ键,36g石墨炔含有碳原子为![]() ,故含有σ键的数目为3.5NA;
,故含有σ键的数目为3.5NA;
故答案为:sp2、sp;3.5NA。,


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列属于酯化反应的是( )
A.CH4 + Cl2 ![]() CH3Cl + HCl
CH3Cl + HCl
B.CH2 = CH2 + Br2![]() CH2BrCH2Br
CH2BrCH2Br
C.nCH2 = CH2 ![]()
![]()
D.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图所示的数字化实验装置,研究常温下,向30mL0.1mol·L-1H2A溶液中逐滴加入等浓度NaOH溶液时pH的变化情况,并绘制出溶液中含A元素的微粒的物质的量分数与溶液pH的关系(如图所示),下列说法错误的是( )
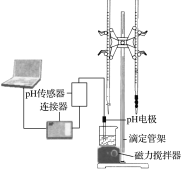
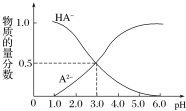
A.pH=4.0时,溶液中n(HA-)约为2.73×10-4mol
B.该实验应将左边的酸式滴定管换成右边的碱式滴定管
C.常温下,含有等物质的量浓度的NaHA与Na2A的混合溶液:pH=3.0
D.0.1mol·L-1NaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)
C. de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-)
D. a点到b点的过程中,溶液的导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家以MoS2为催化剂,在不同电解质溶液中实现常温电催化合成氨,其反应历程与相对能量模拟计算结果如图。下列说法错误的是( )

A. Li2SO4溶液利于MoS2对N2的活化
B. 两种电解质溶液环境下从N2→NH3的焓变不同
C. MoS2(Li2SO4溶液)将反应决速步(*N2→*N2H)的能量降低
D. N2的活化是N≡N键的断裂与N—H键形成的过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应O2(g) +2H2(g) = 2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是( )
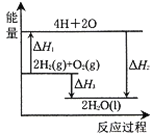
A.ΔH1 < 0
B.ΔH2为该反应的反应热
C.ΔH3为氢气的燃烧热
D.ΔH1= ΔH3-ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.CO2通过Na2O2使其增重a g时,反应中转移的电子数为a/28NA
B.60gSi02中含Si—O键的个数为2NA
C.10g49%的硫酸与10g49%的H3PO4溶液中所含的氧原子数均为0.2NA
D.CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工高温业上冶炼钼的化学反应过程为①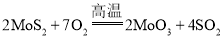 ;②
;②![]() ;③
;③![]() ;④
;④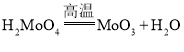 ;⑤用还原剂将
;⑤用还原剂将![]() 还原成金属钼。下列说法正确的是( )
还原成金属钼。下列说法正确的是( )
A.![]() 煅烧产生的尾气可直接排放
煅烧产生的尾气可直接排放
B.![]() 是金属氧化物,也是碱性氧化物
是金属氧化物,也是碱性氧化物
C.![]() 是一种强酸
是一种强酸
D.利用![]() 、
、![]() 和
和![]() 分别还原等量的
分别还原等量的![]() ,所消耗还原剂的物质的量之比为
,所消耗还原剂的物质的量之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.1L0.5mol/LNaHCO3溶液中含有的HCO3-数目小于0.5NA
B.标准状况下,![]() 与
与![]() 在光照条件下反应生成HCl分子数为
在光照条件下反应生成HCl分子数为![]()
C.容器中2molNO与1molO2充分反应,产物的分子数为2NA
D.电解精炼铜时阳极减轻32 g,电路中转移电子数目一定为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com