
【题目】如图为Zn-聚苯胺二次电池的示意图,下列说法正确的是( )
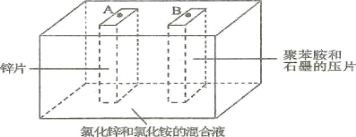
A.放电时,Zn片做负极,发生的电极方程式为Zn + 2e-=Zn2+
B.放电时,混合液中的Cl-向B移动
C.充电时,聚苯胺被氧化
D.充电时,A端接电源的正极
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某抗结肠炎药物的有效成分(R)的结构简式如下。下列说法不正确的是

A. R能发生加成、取代反应
B. R分子中所有C和N原子一定共平面
C. R的苯环上官能团位置异构体有10种
D. R的分子式为C7H7O3N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组制备草酸晶体(H2C2O4·2H2O)的实验装置如下:
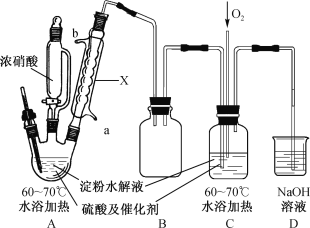
已知:I.草酸(H2C2O4)是二元弱酸,熔点101~102℃;
II.草酸的溶解度如下表所示:
温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g·(100g水)-1 | 9.5 | 14.3 | 21.2 | 31.4 | 46.0 | 84.5 |
III.在催化剂和硫酸存在下,用浓硝酸氧化淀粉水解液可制备草酸,发生的主要反应为:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。
回答下列问题:
(1)装置A中仪器X名称为___________,水从接口___________(填“a”或“b”)进入。
(2)装置B的作用是___________;设计装置C的目的是_________________________。
(3)反应C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O中,每生成1 mol H2C2O4转移电子的物质的量为____________。
(4)将装置A和C中反应液浓缩、静置结晶并过滤得粗草酸晶体,提纯H2C2O4·2H2O的方法是_________________________。
(5)探究草酸的性质:
①向Na2CO3溶液中滴加H2C2O4溶液,产生大量气体,说明草酸的酸性比碳酸________(填“强”或“弱”)。
②向NaClO溶液中加入过量H2C2O4溶液,有气泡产生,能解释这一现象的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池是指在微生物的作用下将化学能转化为电能的装置。某微生物燃料电池的工作原理如图所示,下列说法正确的是(已知质子交换膜的作用是只允许H+通过)( )
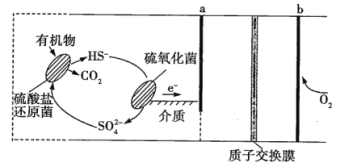
A.该电池在高温下工作的速度更快
B.HS-在硫氧化菌作用下转化为SO42-的电极反应式为HS-+4H2O-8e-=SO42-+9H+
C.b电极是电池的负极
D.该电池工作时,H+向左通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】建设“美丽中国”首先要做好环境保护与治理。氮氧化物(NOx)是严重的大气污染物,其主要来源有汽车尾气和硝酸工厂等。氮氧化物(NOX)能引起雾霾、光化学烟雾、酸雨等环境问题。某科研机构设计了如下转化氮氧化物的几种方案。请回答下列问题:
(1)方案Ⅰ:利用甲烷在催化剂条件下还原NOx,相关反应如下:
①N2(g)+O2(g)=2NO(g) H1=+180.5kJ/mol
②CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) H2= -574kJ/mol
③CH4(g)+4NO(g)=2N2(g)+ CO2(g)+2H2O(l) H3= -1160kJ/mol
则表示甲烷燃烧热的热化学反应方程式是________ 。
(2)方案Ⅱ:利用CO在催化剂条件下还原NOx:2NOx(g)+2xCO(g)N2(g)+2xCO2(g) H。向容积均为2L的甲(温度为T1)、乙(温度为T2)两个恒容密闭容器中分别充入2 mol NO2(g)和3 mol CO(g)。反应过程中两容器内CO2的物质的量浓度随时间的变化关系如图所示:

①甲容器中,平衡时NO2的转化率为____;
②T1___T2(填“>”或“<”);△H___0(填“>”或“<”),判定的依据是____;
③T2温度时,该反应的平衡常数K=____;
④乙容器达到平衡后,再充入3 mol NO2和2 molCO2,此时v(正)___v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
B.有机物![]() 的消去产物有两种
的消去产物有两种
C.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH—COOCH3
D.可用溴水鉴别甲苯、苯酚、1-己烯三种无色液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下:
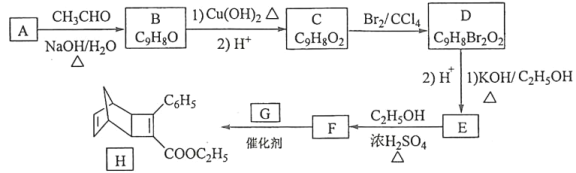
已知:
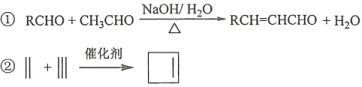
回答下列问题:
(1)A的化学名称是__________。
(2)由C生成D和E生成F的反应类型分别是__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶1∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2–丁炔为原料制备化合物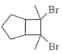 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)经计算需要________mL浓盐酸。
(2)在配制稀盐酸溶液时,选用的仪器除了玻璃棒、烧杯、胶头滴管、还有______________。
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面最低处与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)___________________________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度______(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断错误的是
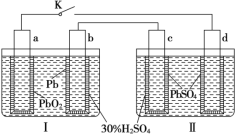
A.K闭合时,d电极反应式:PbSO4+2H2O-2e-=PbO2+4H++SO42-
B.当电路中转移0.2mol电子时,Ⅰ中消耗的H2SO4为0.2mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,c电极为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com