
�����йص������Һ���������ʵ���Ũ�ȹ�ϵ��ȷ����
| A��0.1 mol��L��1��NH4Cl��Һ�У�c(Cl��)��c(NH4+)��c(OH��)��c(H��) |
| B���������ơ���������Һ��Ϻ���Һ�����ԣ����Ϻ����Һ�У�c(Na+)��c(Cl��) |
| C����֪Ka(HF)=7.2��10-4��Ka(HCN)=6.2��10-10���������Ũ�ȵ�NaF��NaCN��Һ�У�ǰ����������С�ں��� |
| D��Ũ�Ⱦ�Ϊ0.1 mol��L��1�Ģ�(NH4)2CO3��(NH4)2SO4��(NH4)2Fe(SO4)2��Һ�У�c(NH4+)�Ĵ�С˳��Ϊ���ۣ��ڣ��� |
BC
�������������A��NH4Cl��ǿ�������Σ�ˮ����Һ�����ԣ���ȷ����c(Cl��)��c(NH4+)��c(H��)��c(OH��)������B���������ơ���������Һ��Ϻ��ݵ���غ㣬c(Na+)+c(H��)=c(Cl��)+c(AC��)+c(OH��),��Һ�����ԣ�c(H��)=c(OH��),�����c(Na+)=c(Cl��)+c(AC��)�����Ի�Ϻ����Һ�У�c(Na+)��c(Cl��)����ȷ��C����Ka(HF)=7.2��10-4��Ka(HCN)=6.2��10-10����֪HCN���Ը������������Ũ�ȵ�NaF��NaCN��Һ�У�NaCN��Һ�ļ���ǿ��������������Ũ�ȴ��ݵ���غ㣬������������Ũ����ȣ���NaCN�е�������Ũ��С����ǰ�������������ں��ߣ�����D����(NH4)2CO3��笠���̼������ܷ���ˮ�⣬��ٽ���笠�Ũ����С����(NH4)2SO4����������笠����ӵ�ˮ�����Ӱ�졣��(NH4)2Fe(SO4)2�ж���������ˮ�����������笠���ˮ�⣬笠�����Ũ�����c(NH4+)�Ĵ�С˳��Ϊ���ۣ��ڣ��١���ȷ��
���㣺���⿼����Һ�����ӵĹ�ϵ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��0.02 mol/L CH3COOH��Һ��0.01 mol/L NaOH��Һ�Ե������ͺ���Һ�����ԣ�����Һ����Ũ�ȹ�ϵ��ȷ��Ϊ
| A��c(CH3COO-)<c(Na+) |
| B��c(CH3COOH)+c(CH3COO-)="0.02" mol/L |
| C��c(CH3COOH)>c(CH3COO-) |
| D��c(OH-)+c(CH3COO-)=c(H+)+c(Na+) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�pH��11�İ�ˮ��pH��1������������ϣ������Һ���Ϊ����Һ���֮�ͣ���ǡ����ȫ��Ӧ��������˵���������
| A����ˮ��Ũ�ȴ��������Ũ�� |
| B��ԭ��ˮ����1%�ĺ�����ΪNH4�� |
| C����ˮ��ˮ�������c(H��)��������ˮ�������c(H��)��100�� |
| D�������Һ��c(NH4��)+c(NH3��H2O)+c(NH3)=5��10��4mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
������0��1 mol��L-1������Һ��pH=a��������ʹ��ҺpH=��a+1)�Ĵ�ʩ��
| A������Һϡ�͵�ԭ�������10�� | B�����������Ĵ����ƹ��� |
| C�������Һ���¶� | D����������0��2 mol��L-1���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����ˮ������ӷ���ʽ��ȷ���Ǹ߿���Դ��
A��HS����H2O S2-��H3O+ S2-��H3O+ |
B��Fe3����3H2O Fe(OH)3����3H�� Fe(OH)3����3H�� |
C��CO32����2H2O H2CO3��2OH�� H2CO3��2OH�� |
D��NH4����H2O NH3��H2O��H�� NH3��H2O��H�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
���н�����ʵ�ķ�Ӧ����ʽ��ȷ����
A����ˮʹ��̪��Һ��죺NH4+ + H2O NH3��H2O + H+ NH3��H2O + H+ |
| B����FeCl3��Һ�м���Mg(OH)2����Һ���к��ɫ�������ɣ�3Mg(OH)2+2Fe3+��2Fe(OH)3+3Mg2+ |
| C��Ǧ���طŵ�ʱ��������ӦΪ��PbO2+2e�C+4H+��Pb2++2H2O |
| D�����������ⸯʴ��������ʴ�ĸ����缫��Ӧ��ͬ��Fe��3e�C��Fe3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����������������Һ���й���������ȷ����
| | �� | �� | �� | �� |
| pH | 11 | 11 | 3 | 3 |
| ��Һ | ��ˮ | ����������Һ | ���� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪ˮ�ĵ��뷽��ʽ��H2O  H�� + OH�������������У���ȷ����
H�� + OH�������������У���ȷ����
| A�������¶ȣ�KW����pH���� |
| B����ˮ�м��백ˮ��ƽ�����淴Ӧ�����ƶ���c(OH��)���� |
| C����ˮ�м����������ᣬc(H��)����KW���� |
| D����ˮ�м�����������CH3COONa��ƽ�����淴Ӧ�����ƶ���c(H��)���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
�����£�Ksp(CaSO4)=9��10-6,������CaSO4��ˮ�еij����ܽ�ƽ������ͼ������˵����ȷ����( )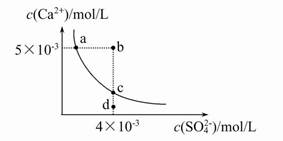
| A��CaSO4��ϡ�����е��ܽ��Ա��ڴ�ˮ�е��ܽ���ǿ |
| B��b�㽫�г������ɣ�ƽ�����Һ��c(SO42-)һ������3��10-3 mol/L |
| C��d����Һͨ���������Ա䵽c�� |
| D��a���Ӧ��Ksp����c���Ӧ��Ksp |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com