
����Ŀ������ֽ���ȡ��������ǵ�ԭ��Ϊ��2H2S��s���TS2��g��+2H2��g������2.0L�����ܱ������г���0.1molH2S����ͬ�¶��²��H2S��ת������ʱ��Ĺ�ϵ��ͼ��ʾ������˵����ȷ���ǣ� �� 
A.ͼ��P�㣺v��������v���棩
B.����ӦΪ���ȷ�Ӧ
C.950��ʱ��0��1.25s����H2��ƽ����Ӧ����Ϊ��0.008molL��1s��1
D.950��ʱ���÷�Ӧ��ƽ�ⳣ����ֵС��3.125��10��4
���𰸡�C
���������⣺A��ͼ��P��δ��ƽ��״̬��������״̬�����մ�ƽ��״̬�������ת���ʱ��Ӧ������Ӧ������У�����v��������v���棩����A����
B�������¶ȣ������ת���ʱ��˵��ƽ�������ƶ�������Ӧ���������ȷ�Ӧ����B����
C��2H2S��g��S2��g��+2H2��g������2.0L�����ܱ������г���0.1molH2S����ʱ�����ת����Ϊ��20%���������ı仯��Ϊ��0.1��0.2=0.02mol������v��H2��= ![]() =0.008molL��1s��1 �� ��C��ȷ��
=0.008molL��1s��1 �� ��C��ȷ��
D��Qc= ![]() =3.125��10��4 �� ����Ӧ�����ƶ�������ƽ�ⳣ����ֵ����3.125��10��4 �� ��D����
=3.125��10��4 �� ����Ӧ�����ƶ�������ƽ�ⳣ����ֵ����3.125��10��4 �� ��D����
��ѡC��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��ļ�������֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч������Ӧ��ת����=ת��Ũ�ȡ���ʼŨ�ȡ�100%=ת�����ʵ�������ʼ���ʵ�����100%����Ʒ�IJ���=ʵ�����ɲ�������ʵ����������Ͽɵõ���������ʵ�����100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H��һ�����ϣ������ڽ����У���������·�ߺϳɣ� 
��֪��R��CH=CH2 ![]() R��CH2CH2OH��B2H6Ϊ�����飩
R��CH2CH2OH��B2H6Ϊ�����飩
�ش��������⣺
��1��11.2L����״��������A�������г��ȼ�տ��Բ���88g CO2��45g H2O��A�ķ���ʽ��
��2��B��C��Ϊһ�ȴ��������ǵ����ƣ�ϵͳ�������ֱ�Ϊ
��3���ڴ���������1mol F��2mol H2��Ӧ������3��������1��������F�Ľṹ��ʽ��
��4����Ӧ�ٵķ�Ӧ��������
��5����Ӧ�ڵĻ�ѧ����ʽΪ
��6��д��������G������ͬ�����ŵ�G�ķ�����ͬ���칹��Ľṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��666���1.01��105 Paʱ����ӦCaCO3��s���TCaO��s��+CO2��g����H=+178.3kJ/mol���Է����е�ԭ���ǣ� ��
A.�¶�����
B.�÷�Ӧ����
C.����ЧӦ��������ЧӦ
D.��Ӧ���ʼӿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��װ�ý�����Ӧʵ�飬�ܴﵽʵ��Ŀ���ǣ�������
A.��ͼ��ʾװ�ó�ȥCl2�к��е�����HCl 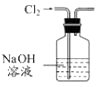
B.��ͼ��ʾװ������NaHCO3��Һ�Ʊ�NaHCO3���� 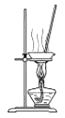
C.��ͼ��ʾװ����ȡ����������CO2���� 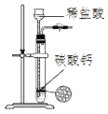
D.��ͼ��ʾװ�÷���CCl4��ȡ��ˮ���Һ̬����� 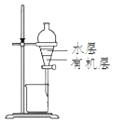
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�������������;���ж�Ӧ��ϵ����(����)
A.SiO2�۵��Ӳ�ȴ������ƹ��ά
B.Al2O3��������������������²���
C.NaHCO3�����ֽ⣬��������θ���кͼ�
D.�ƼغϽ��۵�ͣ������������ӷ�Ӧ�ѵ��Ƚ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������( K2FeO4)��һ�����͵�����ˮ���������������ʺ�������
A.��ǿ�����ԣ�������ɱ������ԭ����ˮ���������ˮ������
B.��ǿ��ԭ�ԣ�������ɱ������������ˮ���������ˮ������
C.��ǿ�����ԣ�������ˮ�����ʣ���ԭ����������ɱ��
D.��ǿ��ԭ�ԣ�������ˮ�����ʣ���������������ɱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2����һ�ָ�Ч��������Ư������Ҫ�����ġ�ֽ����Ư�ף�NaClO2��Һ�п�����ClO2��HClO2��ClO2����Cl�������ֺ����������ⶨ��25��ʱ����ֺ�����pH�仯�����ͼ��ʾ��Cl��û�л������������з�������ȷ���ǣ� �� 
A.������������Һ��ˮϡ�ͣ���Һ��n��ClO2������
B.HClO2�ĵ���ƽ�ⳣ��Ka=1.0��10��6
C.NaClO2��Һ�У�c��Na+��+c��H+����c��ClO2����+c��Cl����
D.pH=5ʱ����Ԫ�ص���Ũ�ȴ�С��ϵΪ��c��HClO2����c��ClO2������c��Cl������c��ClO2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���1L0.1molL��1NH4Cl��Һ�У����ϼ������NaOH��NH4+��NH3H2O�ı仯������ͼ��ʾ������������仯�Ͱ��Ļӷ���������˵����ȷ���ǣ� �� 
A.M����Һ��ˮ�ĵ���̶ȱ�ԭ��Һ��
B.��M��ʱ��n��OH������n��H+��=��a��0.05��mol
C.����NaOH�ļ��룬 ![]() ��������
��������
D.��n��NaOH��=0.05molʱ��Һ���У�c��Cl������c��Na+����c��NH4+����c��OH������c��H+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(����)
A. �Ʊ�����ú�����ԭ��֮һ����������������Ӧ
B. ���ڿ����к�����ȼ��
C. þ���������Ĥ���ɣ����ܱ����ڲ����
D. Fe3O4��������ȡ��ɫ�����Ϳ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com