
【题目】甲醇作为可再生能源,越来越受到人们的关注。已知甲醇制备的有关化学反应的平衡常数及焓变数据如下
化学反应 | 500℃平衡常数 | 焓变 |
①CO(g)+2H2(g) | K1=2.5 | ΔH1=-116 kJ·mol-1 |
②CO2(g)+H2(g) | K2=1.0 | ΔH2=+41 kJ·mol-1 |
③CO2(g)+3H2(g) | K3=? | ΔH3=? |
(1)反应③的K3=__________________,ΔH3=__________________。
(2)500℃时,将2mol CO2和2mol H2充入2L的恒容密闭容器中发生反应②,5min后达到平衡后,则0~5min内,用H2表示的反应速率v(H2)=________。
(3)500℃时,测得反应③在某时刻CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度(mol·L-1)分别为0.1、0.8、0.3、0.15,则此时v正_________v逆(填“>”“<”或“=”)。
(4)若一定量的CO2和H2在绝热恒容的条件下发生上述反应②,下列可以作为判断该反应达到平衡的标志有_________________________。
a.混合气体的平均相对分子质量不再改变
b.混合气体中CO2、H2、H2O、CO(g)的含量相等
c. v(CO2)生成=v(CO)消耗
d.容器内温度不再变化
【答案】2.5 -75 kJ·mol-1 0.1mol/(L![]() min) > d
min) > d
【解析】
(1)反应①+②可得反应③,则平衡常数K3=K1×K2,焓变ΔH3=ΔH1+ΔH2;
(2)利用“三段式法”和化学平衡常数的表达式计算出H2浓度的变化量,用H2表示的反应速率v(H2)=![]() ;
;
(3)500℃时K3=K1×K2=2.5,再计算此时浓度商Qc,若Qc=K3,处于平衡状态,若Qc<K3,反应向正反应进行,若Qc>K3,反应向逆反应进行,进而判断v正、v逆相对大小;
(4)可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析。
(1)反应①+②可得反应③,则平衡常数K3=K1×K2=2.5×1.0=2.5,焓变ΔH3=ΔH1+ΔH2=-116kJ·mol-1+(+41kJ·mol-1)=-75kJ·mol-1,故答案为:2.5;-75kJ·mol-1;
(2)500℃时,将2molCO和2molH2充入2L的恒容密闭容器中发生反应②, 5min后达到平衡,由反应三段式得:
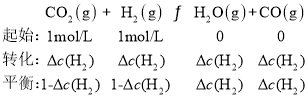
K2=![]() =1.0,解得
=1.0,解得![]() =0.5mol/L,v(H2)=
=0.5mol/L,v(H2)=![]() =
=![]() =0.1mol/(L
=0.1mol/(L![]() min),故答案为:0.1mol/(L
min),故答案为:0.1mol/(L![]() min);
min);
(3)500℃时K3=K1×K2=2.5,浓度商Qc=![]() =0.88<K3=2.5,反应向正反应进行,故v正>v逆,故答案为:>;
=0.88<K3=2.5,反应向正反应进行,故v正>v逆,故答案为:>;
(4) a.反应总质量是个定值,总物质的量是个定值,混合气体的平均相对分子质量一直不变,故a不符合题意;
b.混合气体中CO2、H2、H2O、CO的含量相等,不一定达到平衡状态,故b不符合题意;
c.v(CO2)生成、v(CO)消耗是逆反应的两种物质化学反应速率,不能证明v正=v逆,故c符合题意;
d.绝热容器内温度不再发生变化说明反应达到了平衡,故d符合题意;
故答案为:d。


科目:高中化学 来源: 题型:
【题目】高良姜素是姜科植物高良姜根中的提取物,它能使鼠伤寒沙门氏菌TA98和TA100发生诱变,具有抗病菌作用.下列关于高良姜素的叙述正确的是( )
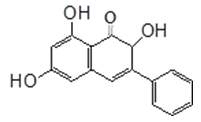
A.高良姜素的分子式为C15H15O5
B.高良姜素分子中含有3个羟基、8个双键
C.高良姜素能与碳酸钠溶液、溴水、酸性高锰酸钾溶液等反应
D.1mol高良姜素与足量的钠反应生成33.6LH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列转化过程分析不正确的是
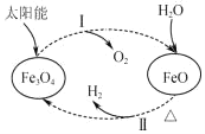
A.Fe3O4 中 Fe 元素的化合价为+2、+3
B.过程Ⅰ中每消耗 58 g Fe3O4 转移 1 mol 电子
C.过程Ⅱ的化学方程式为 3FeO+H2O![]() Fe3O4+H2↑
Fe3O4+H2↑
D.该过程总反应为 2H2O═2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2 ,有关该电池的说法正确的是
A. 放电时电解质溶液中的OH-向正极移动
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性增强
D. 充电时阳极反应:Ni(OH)2-e- + OH- = NiOOH + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的两种一元酸
的两种一元酸![]() 和
和![]() ,体积均为
,体积均为![]() ,稀释过程中
,稀释过程中![]() 与溶液体积的关系如图所示。分别滴加
与溶液体积的关系如图所示。分别滴加![]() 溶液(
溶液(![]() )至
)至![]() ,消耗
,消耗![]() 溶液的体积为
溶液的体积为![]() 、
、![]() ,则( )
,则( )
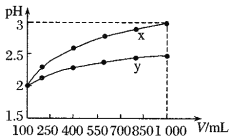
A.![]() 为弱酸,
为弱酸,![]()
B.![]() 为强酸,
为强酸,![]()
C.![]() 为弱酸,
为弱酸,![]()
D.![]() 为强酸,
为强酸,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
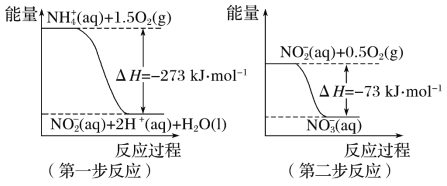
(1)第一步反应是________(填“放热”或“吸热”)反应。
(2)1mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
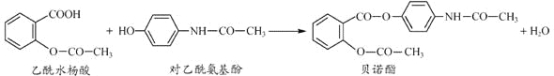
下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体系中存在如下反应:①H2S+4H2O-8e = SO42-+10H+,②2IO3-+12 H++10e = I2+6H2O。
(1)反应①中H2S做_____剂,反应②属于_______ 反应(填“氧化”或“还原”)。
(2)若在反应①中失去0.2 mol 电子,则反应②中可生成______g I2。
(3)写出并配平碘酸钾与硫化氢反应的化学方程式,同时标出电子转移的方向和数目:_____。
(4)由上述反应可推知__________。
a.氧化性:K2SO4> KIO3 b.酸性:HIO3> H2SO4
c.还原性:H2S > I2 d.反应过程中溶液的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com