
【题目】将NaOH和碳酸氢钠的固体混合物20.8 g在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9 g。试计算原混合物中氢氧化钠的质量分数_________?
【答案】19.2%
【解析】
NaOH和碳酸氢钠的固体混合物置于密闭容器中加热,可能发生的化学反应有:
NaHCO3+NaOH![]() Na2CO3+H2O,盐有多余再发生2NaHCO3
Na2CO3+H2O,盐有多余再发生2NaHCO3![]() Na2CO3+H2O+ CO2↑ 。
Na2CO3+H2O+ CO2↑ 。
以上固体混合物加热失重可能只因第1个反应,也可能有以上二个反应共同造成。
若只有NaHCO3+NaOH![]() Na2CO3+H2O造成,则失重4.9 g对应消耗22.9 g NaHCO3和10.9 g NaOH,相比原混合物20.8 g的总质量,所需反应物不足,说明失重由二个反应共同造成。剩余的15.9g固体都是Na2CO3,其物质的量为0.15mol,根据钠守恒,原NaOH和NaHCO3共0.3mol,总质量为20.8g,设NaOH的物质的量为x,NaHCO3的物质的量为y,则
Na2CO3+H2O造成,则失重4.9 g对应消耗22.9 g NaHCO3和10.9 g NaOH,相比原混合物20.8 g的总质量,所需反应物不足,说明失重由二个反应共同造成。剩余的15.9g固体都是Na2CO3,其物质的量为0.15mol,根据钠守恒,原NaOH和NaHCO3共0.3mol,总质量为20.8g,设NaOH的物质的量为x,NaHCO3的物质的量为y,则![]() ,解得x=0.1,y=0.2。所以m(NaOH)=0.1mol×40g/mol=4.0g,其质量分数为w(NaOH)=
,解得x=0.1,y=0.2。所以m(NaOH)=0.1mol×40g/mol=4.0g,其质量分数为w(NaOH)=![]() ×100%≈19.2%。
×100%≈19.2%。


科目:高中化学 来源: 题型:
【题目】(1)在铝表面除去氧化膜,物理方法可用_________,化学方法可将其浸入氢氧化钠溶液,发生反应的化学方程式为:_________;
(2)将除去氧化膜的铝迅速用蒸馏水清洗干净,立即插入硝酸汞溶液片刻,发生反应的离子方程式为:__________________;取出铝片用滤纸吸去表面溶液,铝片上出现的“黑斑”是_________;
(3)将此铝放置于空气中,“黑斑”边会长出“白毛”,此物质是_________.
(4)此实验证明了(________)
A.氧化铝都是十分坚硬的晶体 B.铝是较活泼的金属,可以被空气中氧气氧化
C.铝表面的氧化膜有保护作用 D.铝是很不活泼的金属,不可以被氧气氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论正确的是( )

A. 图甲表示1 mL pH=2某一元酸溶液加水稀释时,pH随溶液总体积的变化曲线,说明该酸是强酸
B. 图乙表示恒容密闭容器中其他条件相同时改变温度,反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ>KⅡ
C. 图丙表示不同温度下水溶液中-lg c(H+)、-lg c(OH-)变化曲线,说明T1>T2
D. 图丁表示1 mol H2和0.5 mol O2反应生成1 mol H2O过程中的能量变化曲线,说明H2的燃烧热是241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠是一种淡黄色固体,能与水反应,常用在呼吸面具和潜水艇里作为氧气的来源,还可用作熔矿剂,使某些不溶于酸的矿物分解。用脱脂棉包住约0.2 g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来。
请回答:(1)由实验现象所得出的有关过氧化钠与水反应的结论是:
a.有氧气生成;b.__________。
(2)某研究性学习小组拟用如图所示装置进行实验,以证明上述结论。
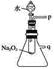
①用以验证结论a的实验方法是:__________;
②用以验证结论b的实验方法是:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为前20号元素且原子序数依次增大,元素
为前20号元素且原子序数依次增大,元素![]() 和
和![]() 同族。盐
同族。盐![]() 与浓盐酸反应,有黄绿色气体产生,
与浓盐酸反应,有黄绿色气体产生,![]() 的焰色反应为浅紫色。下列说法正确的是( )
的焰色反应为浅紫色。下列说法正确的是( )
A.原子半径大小为![]()
B.![]() 简单氢化物的沸点低于
简单氢化物的沸点低于![]() 简单氢化物的沸点
简单氢化物的沸点
C.![]() 与
与![]() 均含有非极性键
均含有非极性键
D.标准状况下,单质![]() 与单质
与单质![]() 的状态相同
的状态相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 和
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
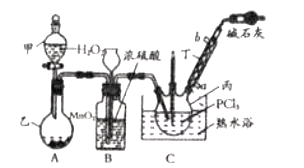
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH=CH2+HBr→CH3CHBrCH3,1mol某烃A充分燃烧后可以得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化。

(1)A的化学式:____________,A的结构简式:__________。
(2)上述反应中,①是__________反应,⑥是__________反应(填反应类型)。
(3)写出 C、D、E 物质的结构简式:C ___________; D _________; E __________。
(4)写出 D→F反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. ![]() 、
、![]() 、H+和H2是氢元素的四种不同粒子
、H+和H2是氢元素的四种不同粒子
B. ![]() 和
和 ![]() 、石墨和金刚石均为同素异形体
、石墨和金刚石均为同素异形体
C. 1H和2H是不同的核素
D. 12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锶可做荧光粉的原料,可通过金属锶与干燥纯净的氮气在460℃时反应制得。锶与镁、钙同主族,能与水、NH3反应。实验室设计以下装置来制备氮化锶(夹持装置略去)。
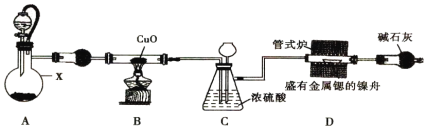
(1)实验简单步骤如下:①连接装置,检验装置的气密性②加装实验药品③点燃B处的酒精灯④加热D处的管式炉⑤打开A处的分液漏斗活塞。正确的实验操作步骤是________。
(2)仪器X的名称是__________;装置A是制取氨气的简易装置,仪器X中的固体是______________。
(3)装置B中的化学方程式是____________________。
(4)装置C的作用是平衡装置中的压强和____________________。
(5)装置D中的固体物质中含有氮化锶,已知氮化锶极易与水反应生成微溶于水的氢氧化锶,写出反应的化学方程式_________________________。
(6)锶的金属性比钠强,但锶与水反应的剧烈程度不如钠,原因足锶的熔点比钠高和____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com