
【题目】(1)在铝表面除去氧化膜,物理方法可用_________,化学方法可将其浸入氢氧化钠溶液,发生反应的化学方程式为:_________;
(2)将除去氧化膜的铝迅速用蒸馏水清洗干净,立即插入硝酸汞溶液片刻,发生反应的离子方程式为:__________________;取出铝片用滤纸吸去表面溶液,铝片上出现的“黑斑”是_________;
(3)将此铝放置于空气中,“黑斑”边会长出“白毛”,此物质是_________.
(4)此实验证明了(________)
A.氧化铝都是十分坚硬的晶体 B.铝是较活泼的金属,可以被空气中氧气氧化
C.铝表面的氧化膜有保护作用 D.铝是很不活泼的金属,不可以被氧气氧化
【答案】砂纸打磨 ![]()
![]()
![]()
![]() BC
BC
【解析】
(1)铝片表面除去氧化膜,物理方法可用砂纸打磨;根据氧化铝两性分析作答;
(2)反应生成硝酸铝和Hg,遵循电子、电荷守恒;
(3)根据铝和汞的化学性质进行分析;
(4)根据铝的性质分析。
(1)铝片表面除去氧化膜,物理方法可用砂纸打磨;利用氧化铝与氢氧化钠的反应来除去反应为:![]() ,
,
故答案为:砂纸打磨;![]() ;
;
(2)除去氧化膜的铝片插入硝酸汞溶液中的离子反应为![]() ;铝片上出现的“黑斑”即为生成的Hg,故答案为:
;铝片上出现的“黑斑”即为生成的Hg,故答案为:![]() ;Hg;
;Hg;
(3)铝化学性质比较活泼,而汞化学性质不活泼,所以生成的白毛为氧化铝,化学式为![]() ;
;
(4)根据以上实验说明,铝是活泼金属,在空气中易被氧化,铝表面的氧化膜有保护作用,B、C项正确,D项错误,该实验不能说明氧化铝是十分坚硬的晶体,A项错误;故答案为:BC。


科目:高中化学 来源: 题型:
【题目】某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的变化。
请回答下列问题。
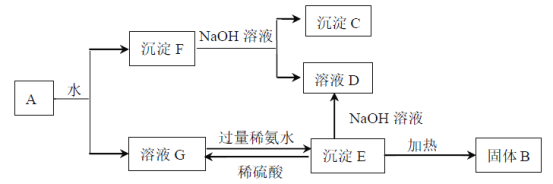
(1)图中涉及分离溶液与沉淀的方法是______________________________。
(2)B、C、D、E4种物质的化学式为:B___________、C___________、D___________、E___________。
(3)沉淀F与NaOH溶液反应的离子方程式为_________________________________。溶液G与过量稀氨水反应的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,3]己烷的结构为![]() ,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
,已知环烷烃的碳原子数越少越容易开环加成。下列说法中正确的是( )
A.![]() 的名称为螺[4,3]辛烷
的名称为螺[4,3]辛烷
B.![]() 的所有碳原子处于一个平面
的所有碳原子处于一个平面
C.螺[2,3]己烷是己烯的同分异构体
D.螺[2,3]己烷加氢可能生成己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”。这种材料可以按下列方法制备:
SiO2![]() Si(粗)
Si(粗)![]() SiHCl3
SiHCl3![]() Si(纯),下列说法正确的是( )
Si(纯),下列说法正确的是( )
A.步骤①的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
B.步骤①、②、③中每生成或反应1 mol Si,转移4 mol电子
C.二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D.SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期元素的离子![]() 、
、![]() 、
、![]() 、
、![]() 都具有相同的电子层结构,则下列叙述正的是
都具有相同的电子层结构,则下列叙述正的是
A.原子半径A>B>D>CB.原子序数d>c>b>a
C.离子半径C>D>B>AD.单质的还原性A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究氨的还原性及检验产物的性质,按下图装置进行实验(图中夹持装置已略去)。将B处的三氧化二铬加热至红热,再鼓入空气,已知:无水氯化钙可吸收氨气和水。回答下列问题:
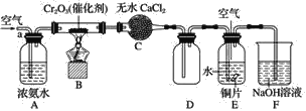
(1)B中发生反应的化学方程式是______________________________。
(2)证明氨气发生催化氧化的现象是________________,反应的方程式是________________。
(3)E中铜发生反应的离子方程式是________________________________。
(4)E中缓缓通入空气的目的是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )
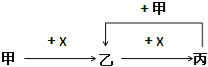
A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)ICl、ICl3的化学性质与卤素相似,被称为卤素互化物。三氯化碘(ICl3,其中Cl为-1价)常以二聚体的I2Cl6形式存在,经电导仪测定知,它能发生部分电离,生成的两种离子的摩尔质量分别为198 g/mol和269 g/mol,则其电离方程式为 ________________ 。
(2)向盛有一定量的溴化亚铁溶液和四氯化碳溶液的试管中持续通入氯气,反应完毕后,振荡、静置、分层,发现有机层呈红棕色,经检验生成了BrCl(其中Cl为-1价)。可能发生如下反应:
①2Br-+Cl2=2Cl-+Br2 ②Br2+Cl2=2BrCl ③2Fe2++Cl2=2Fe3++2Cl-
按通入氯气,发生先后反应的顺序为 ____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaOH和碳酸氢钠的固体混合物20.8 g在密闭容器中加热到约250 ℃,经充分反应后排出气体,冷却,称得剩余固体的质量为15.9 g。试计算原混合物中氢氧化钠的质量分数_________?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com