
����Ŀ����1��ICl��ICl3�Ļ�ѧ������±�����ƣ�����Ϊ±�ػ�������Ȼ��⣨ICl3������ClΪ-1�ۣ����Զ������I2Cl6��ʽ���ڣ����絼�Dzⶨ֪�����ܷ������ֵ��룬���ɵ��������ӵ�Ħ�������ֱ�Ϊ198 g/mol��269 g/mol��������뷽��ʽΪ ________________ ��
��2����ʢ��һ�������廯������Һ�����Ȼ�̼��Һ���Թ��г���ͨ����������Ӧ��Ϻ������á��ֲ㣬�����л���ʺ���ɫ��������������BrCl������ClΪ-1�ۣ������ܷ������·�Ӧ��
��2Br��+Cl2=2Cl��+Br2 ��Br2+Cl2=2BrCl ��2Fe2��+Cl2=2Fe3��+2Cl��
��ͨ�������������Ⱥ�Ӧ��˳��Ϊ ____________������ţ���
���𰸡�I2Cl6![]() ICl2��+ICl4�� �ۢ٢�
ICl2��+ICl4�� �ۢ٢�
��������
��1�����ɵ��������ӵ�Ħ�������ֱ�Ϊ198g/mol��269g/mol���ֱ�ΪICl2+��ICl4-���ܷ������ֵ��룬˵��Ϊ������ʣ�
��2�����ݻ�ԭ��ǿ���жϷ�Ӧ��˳��
��1�����Ȼ���(ICl3������ClΪ1��)���Զ������I2Cl6��ʽ���ڣ����絼�Dzⶨ֪�����ܷ������ֵ��룬���ɵ��������ӵ�Ħ�������ֱ�Ϊ198g/mol��269g/mol���ֱ�ΪICl2+��ICl4��������뷽��ʽΪI2Cl6ICl2++ICl4���ʴ�Ϊ��I2Cl6ICl2++ICl4��
��2���������ӻ�ԭ����ǿ��ͨ��������Ӧ�ȷ�����Ӧ������ͨ�����������������ӣ������巴Ӧ����BrCl����˳��Ϊ�ۢ٢ڣ��ʴ�Ϊ���ۢ٢ڡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ǵؿ��к�����21�ḻԪ�أ�������������Ԫ�أ����������Ͱ�֢��������Ѫ�ܵȾ���DZ�ڵ�ҩ��ѧ���á���ҵ���ú����۷�![]() Ϊ����ijʯúΪԭ��(����
Ϊ����ijʯúΪԭ��(����![]() ��CaO������)���ƻ��������Ʊ�
��CaO������)���ƻ��������Ʊ�![]() �����������£�
�����������£�
![]()
��֪��+5�۷�����Һ�е���Ҫ������ʽ����ҺpH�Ĺ�ϵ���±���
pH | 4~6 | 6~8 | 8~10 | 10~12 |
��Ҫ���� |
|
|
|
|
(1)���գ���ʯú�м���ʯ�ұ��գ���![]() ת��Ϊ
ת��Ϊ![]() �Ļ�ѧ����ʽ��________________��
�Ļ�ѧ����ʽ��________________��
(2)�����![]() ������ˮ�����������ᡣ����ɰ���ʱ��Һ��
������ˮ�����������ᡣ����ɰ���ʱ��Һ��![]() ��
��![]() ������������ӷ���ʽ��________________��
������������ӷ���ʽ��________________��
(3)ת����������Һ�еķ�ת��Ϊ![]() ���壬���������£�
���壬���������£�
![]()
�ٽ���Һ�м���ʯ�����������____________________________________��
����![]() ��Һ�м���
��Һ�м���![]() ��Һ��������Һ��
��Һ��������Һ��![]() ����
����![]() ʱ��
ʱ��![]() �IJ������Խ��ͣ�ԭ����_______________________________________��
�IJ������Խ��ͣ�ԭ����_______________________________________��
(4)ʵ������![]() Ϊԭ�ϻ����Ժϳ������Ʊ�
Ϊԭ�ϻ����Ժϳ������Ʊ�![]() ������(IV)��ʽ̼��茶��壬�������£�
������(IV)��ʽ̼��茶��壬�������£�
![]()
�ٲ�����������ͼװ��(����������)�н��С���֪��![]() �ܱ�
�ܱ�![]() ������
������
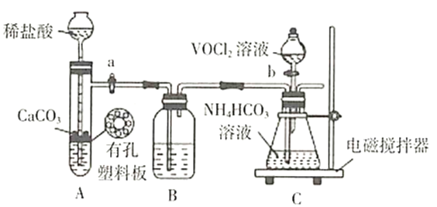
ҩƷ��װ��ɺ��ʵ�������________(��������a����������b���IJ���˳��)��װ��B�е��Լ���________��
�ڲⶨ����(IV)��ʽ̼��茶���ֲ�Ʒ�з��ĺ�����
����4.246g��Ʒ����ƿ�У���20mL����ˮ��30mL�������ܽ��![]() ��
��![]() ��Һ���Թ�������ַ�Ӧ�������1%
��Һ���Թ�������ַ�Ӧ�������1%![]() ��Һ���Թ������������س�ȥ������
��Һ���Թ������������س�ȥ������![]() �������
�������![]() ��
��![]() ����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ��
����Һ�ζ����յ㣬�������Ϊ30.00mL(�ζ���Ӧ�� )��
)��
![]() ��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
��Һ��������________________���ֲ�Ʒ�з�����������Ϊ________________(��ȷ��С�������λ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����������ȥ����Ĥ��������������_________����ѧ�����ɽ����������������Һ��������Ӧ�Ļ�ѧ����ʽΪ��_________��
��2������ȥ����Ĥ����Ѹ��������ˮ��ϴ�ɾ��������������ṯ��ҺƬ�̣�������Ӧ�����ӷ���ʽΪ��__________________��ȡ����Ƭ����ֽ��ȥ������Һ����Ƭ�ϳ��ֵ����ڰ�����_________��
��3�������������ڿ����У����ڰ����᳤������ë������������_________.
��4����ʵ��֤������________��
A.����������ʮ�ּ�Ӳ�ľ��� B.���ǽϻ��õĽ��������Ա���������������
C.�����������Ĥ�б������� D.���Ǻܲ����õĽ����������Ա���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�NH4Cl��CuO�ķ�Ӧ����������ʵ��(����װ����)��
ʵ�� | �� | �� |
װ�� |
|
|
���� | �����Թܣ��������̣��Թܿ��а�ɫ���壻�Թ�����ˮ���ɣ��������ȣ���ɫ������������ղ��ֱ�Ϊ��ɫ | ��ϸ�����ܿڼ��������ȣ�Ѹ�ٴ�ֱ���� NH4Cl�����У�һ��ʱ���ȡ�������ܣ��ܿڴ�������ɫ���� |
����⣬ʵ����еĻ�ɫ���庬��CuCl��CuCl2��ʵ����е�����ɫ����ΪCu��
(1)ʵ������Թܿڵİ�ɫ������______��
(2)ʵ����к�ɫ������������ղ��ֹ����Ϊ��ɫ�Ĺ����У����������±仯��
![]()
��(NH4)2CuCl4�������ȷֽ�Ļ�ѧ����ʽ��______��
�ڶ�������X���������¼��裺
����X��NH4Cl��
��Ӧ����ʽΪ��________________________________(��������)
����X��______��������______��
(3)ʵ����ʵ��������ͬ�����ܵ�ԭ����______(�г�2��)��
(4)NH4Cl��Һ��CuO��Ӧ��
ʵ��� ��CuO��ĩ�м���0.1 mol��L1 NH4Cl��Һ������һ��ʱ����岿���ܽ⣬��������ɫ�仯����Һ��Ϊ��ɫ��
���ϣ������������ˮ��Һ�е���ɫ��Cu2+��ɫ��Cu(NH3)2+��Cu(NH3)42+����ɫ
����Cu(NH3)2+![]() Cu2++NH3 Cu(NH3)42+
Cu2++NH3 Cu(NH3)42+![]() Cu2++4NH3
Cu2++4NH3
�����ʵ��֤��ʵ���õ�����ɫ��Һ�д���Cu(NH3)2+��Cu(NH3)42+��
ʵ�鷽����______��
��ʵ�����δ�۲쵽NH4Cl��Һ��CuO����������ԭ��Ӧ�IJ�����ܵ�ԭ����______(�г�1�㼴��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͬ���ʵ���Ũ�ȵĢ�CH3COOH ��Һ�������ᣬc(H+)�ϴ����____________�����ţ���CH3COOH �ĵ��뷽��ʽΪ____________��
��2��FeCl3��Һ����ʱ�������____________������ᡱ�����ᡱ����
��3���״� CH3OH ��һ����Ҫ�Ļ���ԭ�ϣ������������Ź㷺��Ӧ�á��ϳ� CH3OH ��һ�� ��ӦΪ��CO(g) + 2H2(g)![]() CH3OH (g)��һ�������£��� 1 mol CO �� 2 mol H2�� 1L �����з���������Ӧ������ 2 min ��Ӧ������ a mol CH3OH����Ӧǰ��������䣩��
CH3OH (g)��һ�������£��� 1 mol CO �� 2 mol H2�� 1L �����з���������Ӧ������ 2 min ��Ӧ������ a mol CH3OH����Ӧǰ��������䣩��
�ٴ�ʱ CO ��Ũ��Ϊ____________mol/L ��
��2min ���� H2 ��ʾ�÷�Ӧ������Ϊ v(H2) =____________mol/(L��min)��
�������¶ȣ���Ӧ��ƽ�ⳣ�� K ��С����÷�ӦΪ____________������ȷ�Ӧ�����ȷ�Ӧ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ϊ��������ѧ���������ǿ�����ѧ����֪ʶ����������е�һЩ���⣬������ѧϰ����ҪĿ��֮һ������ij��ѧʵ����ȤС�飬һ�����ˣ�����ʵ������ʦ�ṩ�Ļ���������ҩƷ�����й����˼�����ʳ��������Ʒ������������̽����
I.��ͬѧ�ϼ������У��Զ�ʱ�ڼ���Ʒ�����������ϳ´���ζ�������£����游ĸ�����ɶ������Ǿ��ó����Ĵײ����ʱ��ζ��������������Ϻ�֪��ͼ1��Ϣ��
�ٴ����֣���������ƴף����ڵ��ϳ´ױ��뾭����ʱ������ŵô���ζ���г��϶����Ź�ҵ�����ˮ���ҵ����ƴף�
��������ұ�Ϊ���Ậ���������3.50g/100mL�������ƴ��ұ���Ϊ1.50g��3.50g/100mL��
������ʦ�İ����£��ⶨ�˳��й����ʳ���У���������ʵ���Ũ��Ϊ0.75mol/L��
��1���������ͬѧ����ӳ��й����ʳ���д��Ậ��Ϊ_____g/100mL������_____�ף�����������������������������ʾ������Ħ������Ϊ60g/mol��
��2����д�������뼦���ǣ���Ҫ�ɷ�ΪCaCO3����Ӧ�����ӷ���ʽ_____��
II.��ͼ1�dz��⻯ѧʵ����Ũ�����Լ���ǩ�ϵIJ������ݣ���ͬѧ���ø�Ũ��������100mL 1molL��1��ϡ���ᣮ�ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ�����ƿ�����ձ�����ҩ�ף�����Ͳ����������ƽ���߲���������ش��������⣺
��1������ϡ����ʱ����ȱ�ٵ�������_____��
��2�������㣬����100mL1molL��1��ϡ������Ҫ����Ͳ��ȡ����Ũ��������Ϊ_____mL������С�����һλ����
��3���������Ƶ�ϡ������вⶨ��������Ũ��С��1molL��1����������ԭ�������_____��
A������ʱ��������ƿ�̶���
B������ƿ��ʹ��ǰδ�����������������ˮ
C��ת����Һ��δϴ���ձ��Ͳ�����
D������ҡ�Ⱥ���Һ���������ƿ�Ŀ̶��ߣ��ټ�ˮ���̶���
III.��ͬѧ�Կ�����ѧ���Ľ�������֪ʶ������Ũ����Ȥ��
��1�������������ļ����ĵ������Ƴ���Һ���ü����������Һ������һ������������������Һ���������Ϊ_____��
��2��������ͬѧ���ƺõ�������Һ���뵽��������Һ�У����ֳ�����״�������������Ϊ_____��
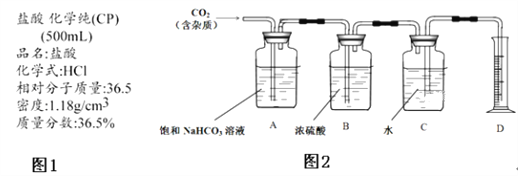
IV.��ͬѧ��ͼ�ⶨCO2����Է���������
�����ñ�ͬѧ�����ʣ�µļ����Ǻ���ͬѧ���ƺõ�ϡ������Һ�Ʊ�CO2��
�ڲ�ѯ����鼮���������ͼ2��ʾװ�ã�
��1������ͬѧ��ΪBװ���ڴ˴�û��Ҫ�������ԭ��_____��
��2��Aװ���еı���NaHCO3��Һ��������_____��
��3��ʵ��ǰ���Cװ�ã���ˮ������Ϊ50.00g��ʵ����Ϻ�Cװ�ã���ˮ������Ϊ40.02g��D����Ͳ����Ϊ10.0mL����֪H2�ܶ�Ϊ0.09g/L���������ݾ����ۺ�Ϊ�������ֵ����������������ݣ�����CO2����Է�������Ϊ_____������С�����һλ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ�����ȷ����(����)

A. ͼ�ױ�ʾ1 mL pH��2ijһԪ����Һ��ˮϡ��ʱ��pH����Һ������ı仯���ߣ�˵��������ǿ��
B. ͼ�ұ�ʾ�����ܱ�����������������ͬʱ�ı��¶ȣ���ӦCO2(g)��3H2(g) ![]() CH3OH(g)��H2O(g)��n(CH3OH)��ʱ��ı仯���ߣ�˵����Ӧƽ�ⳣ��K��>K��
CH3OH(g)��H2O(g)��n(CH3OH)��ʱ��ı仯���ߣ�˵����Ӧƽ�ⳣ��K��>K��
C. ͼ����ʾ��ͬ�¶���ˮ��Һ�У�lg c(H��)����lg c(OH��)�仯���ߣ�˵��T1>T2
D. ͼ����ʾ1 mol H2��0.5 mol O2��Ӧ����1 mol H2O�����е������仯���ߣ�˵��H2��ȼ������241.8 kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ�ֵ���ɫ���壬����ˮ��Ӧ�������ں�����ߺ�DZˮͧ����Ϊ��������Դ�����������ۿ����ʹijЩ��������Ŀ���ֽ⡣����֬�ް�סԼ0.2 g�������Ʒ�ĩ������ʯ�����ϣ�����֬���ϵ�ˮ���ɹ۲쵽��֬����ȼ��������
��ش𣺣�1����ʵ���������ó����йع���������ˮ��Ӧ�Ľ����ǣ�
a�����������ɣ�b.__________��
��2��ij�о���ѧϰС��������ͼ��ʾװ�ý���ʵ�飬��֤���������ۡ�
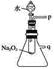
��������֤����a��ʵ�鷽���ǣ�__________��
��������֤����b��ʵ�鷽���ǣ�______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵��������ǣ� ��
A. ![]() ��
��![]() ��H����H2����Ԫ�ص����ֲ�ͬ����
��H����H2����Ԫ�ص����ֲ�ͬ����
B. ![]() ��
�� ![]() ��ʯī�ͽ��ʯ��Ϊͬ��������
��ʯī�ͽ��ʯ��Ϊͬ��������
C. 1H��2H�Dz�ͬ�ĺ���
D. 12C��14C��Ϊͬλ�أ��������ʲ�ͬ������ѧ���ʼ�����ȫ��ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com