
【题目】常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、 NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
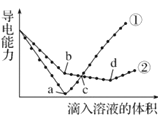
A.b点,水电离产生的c(H+)< 10-7 mol/LB.①代表滴加H2SO4溶液的变化曲线
C.a、d两点对应的溶液均显中性D.c点,两溶液中含有相同量的 OH-
【答案】D
【解析】
首先根据图象中出现的拐点判断哪个表示的是什么溶液的滴定曲线,然后根据加入Ba(OH)2的体积多少及溶液的导电能力判断溶液中含有的离子种类及浓度大小。
A.根据图知,a点为Ba(OH)2溶液和H2SO4恰好反应,曲线①表示硫酸滴定曲线,②表示NaHSO4的滴定曲线。H2SO4、NaHSO4溶液的物质的量浓度相等,则b点溶液溶质为NaOH,抑制水电离,所以b点水电离产生的c(H+)< 10-7 mol/L,A正确;
B.Ba(OH)2溶液和H2SO4、NaHSO4溶液反应方程式分别为H2SO4+ Ba(OH)2=BaSO4↓+2H2O、NaHSO4+Ba(OH)2=BaSO4↓+NaOH+H2O,2NaHSO4+Ba(OH)2=BaSO4↓+Na2SO4+2H2O,溶液导电能力与离子浓度成正比,根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为Ba(OH)2溶液和H2SO4的反应,则曲线②为Ba(OH)2溶液和NaHSO4溶液的反应,即①代表滴加H2SO4溶液的变化曲线,B正确;
C.a点①中硫酸和氢氧化钡恰好完全反应,溶液中只含水;d点②中溶质为Na2SO4,水和硫酸钠溶液都呈中性,C正确;
D.c点,①中稀硫酸过量,溶质为硫酸,②中硫酸氢钠过量,则溶质为NaOH、Na2SO4,因为硫酸根离子浓度相同,②中钠离子浓度大于①中氢离子浓度,所以溶液中氢氧根离子浓度不同,D错误;
故合理选项是D。


科目:高中化学 来源: 题型:
【题目】科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus—罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene。该有机物的结构简式如图所示:
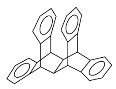
下列说法正确的是( )
A.该有机物属于苯的同系物
B.该有机物完全燃烧生成CO2和H2O的物质的量之比为15∶11
C.该有机物的一氯代物只有4种
D.该有机物只能发生取代反应而不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
B.可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
C.白炽灯工作时,电能全部转化为光能
D.日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题:
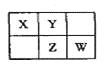
(1)W的最高价氧化物化学式是________________;Z的原子结构示意图为______。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为_____________。
(3) AW3可用于净水,其原理是_____________。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是__________________。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)_______________________________。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
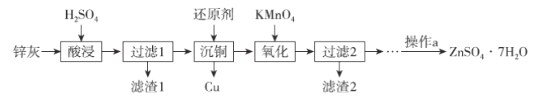
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三个容器中最初存在的物质及数量如图所示,三个容器最初的容积相等,温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
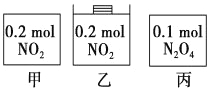
A. 平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B. 平衡时N2O4的百分含量:乙>甲=丙
C. 平衡时甲中NO2与丙中N2O4的转化率相同
D. 平衡时混合物的平均相对分子质量:甲>乙>丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加水,平衡向逆反应方向移动
B.滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少
C.加入少量CH3COONa固体,平衡向正反应方向移动
D.加入少量NaOH固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
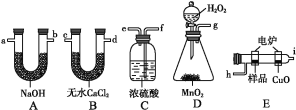
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是___(填字母)。
(2)装置C中浓硫酸的作用是___。
(3)燃烧管中CuO的作用是___。
(4)若准确称取0.69g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32g,B管质量增加0.81g,则该有机物的实验式为___。
(5)经测定其蒸气密度为2.054g/L(已换算为标准状况),则其分子式为___。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为___。
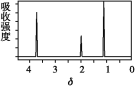
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室模拟合成氨和氨催化氧化的流程如下:

已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气。
(1)从如图中选择制取气体的合适装置:氮气________、氢气________。
(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还有________、________。

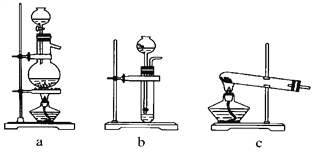
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,________(“会”或“不会”)发生倒吸,原因是_________________。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是________,锥形瓶中还可观察到的现象是____________________________。
(5)写出乙装置中氨氧化的化学方程式:_____________________________________________。
(6)反应结束后锥形瓶内的溶液含有H+、OH-、______、________离子。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com