
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
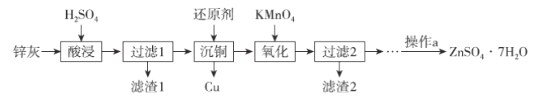
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
【答案】+4 PbSO4 3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+ 蒸发浓缩、冷却结晶 71% 2Zn2++2H2O![]() 2Zn+4H+
2Zn+4H+
【解析】
钡白矿(锌灰的主要成分是ZnO,还含有CuO、PbO、MnO和FeO),加稀硫酸溶解,得到金属硫酸盐,PbSO4不溶,其余硫酸盐以溶于水,过滤,滤渣1为PbSO4,滤液中含有硫酸锌、CuSO4、FeSO4、MnSO4,加入锌粉发生置换反应:Zn+CuSO4=Cu+ZnSO4,滤渣为铜与过量的锌粉,滤液中再加高锰酸钾溶液,Fe2+与MnO4-反应生成Fe(OH)3、MnO(OH)2沉淀,滤渣2的主要成分为成Fe(OH)3、MnO(OH)2,过滤,滤液为硫酸锌,蒸发浓缩、冷却结晶、过滤得到ZnSO4·7H2O晶体。
(1)MnO(OH)2中Mn元素的化台价为+4价;
(2)根据上述分析可知“滤渣1”的主要成分为PbSO4;
(3)KMnO4具有强的氧化性,Fe2+具有还原性,在pH=5.1时,Fe2+被氧化产生Fe3+与溶液中OH-结合形成Fe(OH)3沉淀,MnO4-被还原产生MnO(OH)2 ,故根据电子守恒、电荷守恒、原子守恒,可得Fe2+被氧化的离子方程式为:3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+;
(4)滤液2主要成分是ZnSO4,由于ZnSO4的溶解度受温度的影响变化较大,所以从该溶液中得到硫酸锌晶体的操作a为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)ZnSO4·7H2O与EDTA按物质的量之比1:1反应,根据表中数据,ZnSO4·7H2O产品的纯度为:![]() ×100%=71%;
×100%=71%;
(6)在工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,阴极上Zn2+得到电子发生还原反应变为Zn单质,电极反应式为:Zn2++2e-=Zn,阳极上水电离产生的OH-失去电子发生氧化反应产生O2,电极反应式为:2H2O=O2↑+4H+,故电解过程中的离子方程式:2Zn2++2H2O![]() 2Zn+4H+。
2Zn+4H+。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足导致的饥饿和死亡问题,这也充分说明了含氮化合物对人类生存的巨大意义。回答下列问题
(1)工业上用氢气和氮气直接合成氨,写出反应的化学方程式_______________。氨气极易溶于水,水溶液显 _____性,能使酚酞溶液变____色,使湿润的红色石蕊试纸变_____色。
(2)氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与空气变___色,原因是__________(用化学方程式表示);二氧化氮易溶于水并与水反应,此反应的氧化剂是_______,还原剂是______,氧化剂和还原剂的质量之比为______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )。
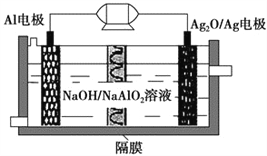
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.1 mol
C. Al电极的反应式为Al-3e-+4OH-=AlO2-+2H2O
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在两份相同的 Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、 NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是( )
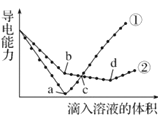
A.b点,水电离产生的c(H+)< 10-7 mol/LB.①代表滴加H2SO4溶液的变化曲线
C.a、d两点对应的溶液均显中性D.c点,两溶液中含有相同量的 OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①④B.①②C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是

A.反应前2min的平均速率v(Z)<2.0×103mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)>0.24mol·L-1
D.该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图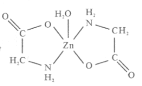 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物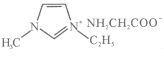 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
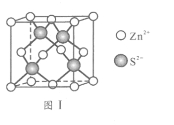
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com