
【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】已知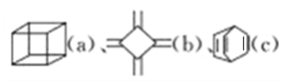 的分子式均为C8H8,下列说法正确的是( )
的分子式均为C8H8,下列说法正确的是( )
A.c可与酸性高锰酸钾溶液反应,a和b不行
B.a、b 的二氯代物均有3种,c的二氯代物有6种
C.a的同分异构体中除b、c外,还可以是苯的同系物
D.a、b、c中只有b、c的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
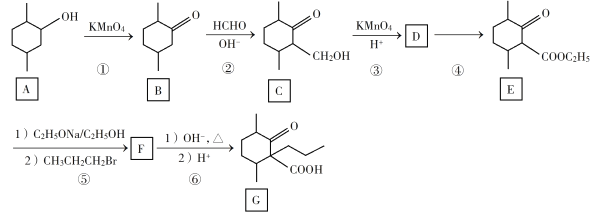
回答下列问题:
(1)C中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中,用星号(*)标出B中的手性碳_____________________。
(3)写出具有六元环结构、且环上只有1个取代基,并能与NaOH溶液发生反应的C的同分异构体的结构简式______________。(不考虑立体异构,只需写出2个)
(4)反应④所需的试剂和条件是____________________。
(5)②、⑤的反应类型是____________________。
(6)写出F到G的反应方程式_____________ 、_______________。
(7)乙酸苯甲酯(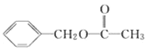 )是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
)是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.侯氏制碱法的工艺过程中主要应用了物质熔沸点的差异
B.可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气
C.白炽灯工作时,电能全部转化为光能
D.日本福岛核电站核泄漏事故提醒我们不要开发新能源,要大力挖掘化石能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
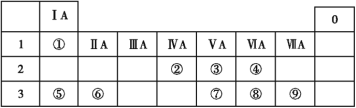
请按要求回答下列问题。
(1)元素③的名称是__,元素⑨的元素符号是____,元素④形成的单质具有____(填“氧化性”或“还原性”)。
(2)元素⑦⑧⑨的气态氢化物的稳定性由弱到强的顺序:____(用化学式表示)。
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:_____。
(4)写出元素⑤形成的单质与水反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题:
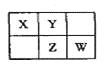
(1)W的最高价氧化物化学式是________________;Z的原子结构示意图为______。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为_____________。
(3) AW3可用于净水,其原理是_____________。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是__________________。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)_______________________________。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
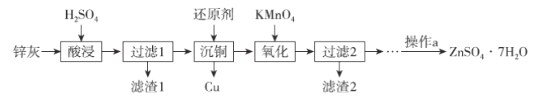
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加水,平衡向逆反应方向移动
B.滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少
C.加入少量CH3COONa固体,平衡向正反应方向移动
D.加入少量NaOH固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
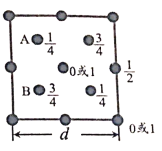
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com