
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是

A.反应前2min的平均速率v(Z)<2.0×103mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)>0.24mol·L-1
D.该温度下此反应的平衡常数:K=1.44
【答案】D
【解析】
A.反应前 2 min 内Y的改变量为0.04mol,则Z改变量为0.08mol,2min内Z的平均速率v(Z)=Δn/Δt=![]() =4×103mol·(L·min)1,故A错误;
=4×103mol·(L·min)1,故A错误;
B.其他条件不变,降低温度,平衡向放热方向移动,正向移动,反应达到新平衡前:v(正)>v(逆),故B错误;
C.充入气体X和气体Y各0.16mol,平衡时Y的物质的的量为0.10mol,则改变量为0.06mol,此时Z的物质的量为0.12mol,浓度为0.012molL1,保持其他条件不变向容器中充入0.32mol气体X和0.32 mol气体Y,用建模思想,相当于两个容器,缩小容器加压,平衡不移动,浓度为原来2倍,即c(Z) = 0.024 mol·L1,故C错误;
D.平衡时,Y的物质的量为0.1mol,X的物质的量为0.1mol,Z的物质的量为0.12mol,该温度下此反应的平衡常数 ,故D正确;
,故D正确;
答案选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
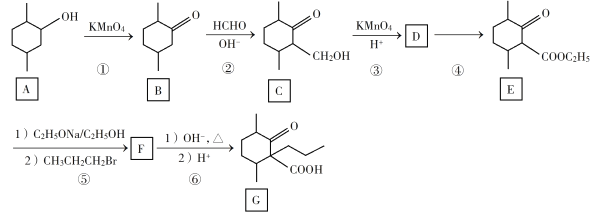
【题目】化合物G是一种药物合成中间体,其合成路线如下:
回答下列问题:
(1)C中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中,用星号(*)标出B中的手性碳_____________________。
(3)写出具有六元环结构、且环上只有1个取代基,并能与NaOH溶液发生反应的C的同分异构体的结构简式______________。(不考虑立体异构,只需写出2个)
(4)反应④所需的试剂和条件是____________________。
(5)②、⑤的反应类型是____________________。
(6)写出F到G的反应方程式_____________ 、_______________。
(7)乙酸苯甲酯(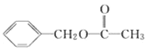 )是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
)是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
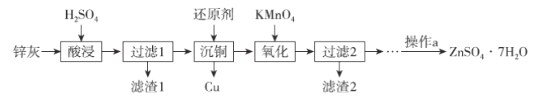
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加水,平衡向逆反应方向移动
B.滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少
C.加入少量CH3COONa固体,平衡向正反应方向移动
D.加入少量NaOH固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
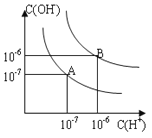
(1)则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______________。
(2)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______。
(3)25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常将一定量的有机物充分燃烧转化为简单的无机物,然后根据产物的质量确定有机物的组成。如图所示是用燃烧法确定有机物分子式的常用装置。
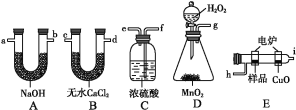
请回答下列问题:
(1)使产生的O2按从左到右的方向流动,则所选装置中各导管的正确连接顺序是___(填字母)。
(2)装置C中浓硫酸的作用是___。
(3)燃烧管中CuO的作用是___。
(4)若准确称取0.69g样品(只含C、H、O三种元素中的两种或三种),充分燃烧后,A管质量增加1.32g,B管质量增加0.81g,则该有机物的实验式为___。
(5)经测定其蒸气密度为2.054g/L(已换算为标准状况),则其分子式为___。
(6)该物质的核磁共振氢谱如图所示,则其结构简式为___。
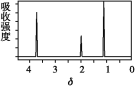
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸
B.用二氧化硅制取单质硅时,当生成2.24L气体(标准状况)时,得到2.8g硅
C.6g的二氧化硅中含有0.2mol的共价键
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
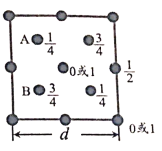
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)又叫乙二酸,广泛存在于植物源食品中,25℃时,其解离常数Kal=5.9×10-2; Ka2= 6.4×10-5。下列与草酸有关的说法错误的是
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) △H >0;升温有利于提高草酸的电离程度
B.草酸中的碳为+3价,具有较强的还原性,可使酸性高锰酸钾溶液褪色
C.25℃时,KHC2O4溶液呈弱酸性,有时用于清洗金属表面的锈迹
D.同浓度的KHC2O4和K2C2O4混合溶液中:2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com