
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
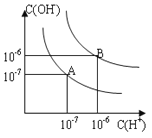
(1)则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______________。
(2)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______。
(3)25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________。
【答案】A 水的电离是吸热过程,温度低,电离程度小,c(H+)、c(OH-)小 a+b=13或 pH1+pH2=13 2:9 曲线B对应95℃,此时水的离子积为10-12,HA为弱酸,HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5
【解析】
(1)根据水的电离是吸热过程,升高温度,使水的电离程度增大分析;
(2) 95℃时水的离子积常数Kw=1×10-12,根据两种溶液恰好反应时,n(H+)=n(OH-)计算;
(3) 25℃时水的离子积常数Kw=1×10-14,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,溶液显碱性,根据酸、碱反应的物质的量关系,计算出过量的OH-的浓度,利用pH=-lgc(H+)计算NaOH溶液与H2SO4溶液的体积比;
(4)根据曲线B对应温度下水的离子积常数Kw=1×10-12,混合溶液pH=5,说明反应后溶液显示酸性,根据反应后氢离子过量分析。
(1)水是一种极弱的电解质,在溶液中存在电离平衡,电离过程吸收热量,当温度升高时,促进水电离,水的离子积也增大,水中氢离子浓度、氢氧根离子浓度都增大,但由于c(H+)=c(OH-),实验溶液仍然呈中性;因此结合图象中A、B曲线变化情况可知A曲线上c(H+)、c(OH-)较小,水电离程度较弱,因此可以判断25℃时水的电离平衡曲线应为A;
(2)根据图象可知:95℃时,水的离子积常数Kw=1×10-12,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则10×10-a=1×![]() ,10(1-a)=10(b-12),1-a= b-12,所以a+b=13,即混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2=13;
,10(1-a)=10(b-12),1-a= b-12,所以a+b=13,即混合前,该强酸的pH1与强碱的pH2之间应满足的关系是pH1+ pH2=13;
(3)25℃时,水的离子积常数Kw=1×10-14,pH=11的NaOH溶液,c(OH-)=10-3mol/L,pH=4的H2SO4溶液c(H+)=10-4mol/L,两种溶液混合,发生反应:H++OH-=H2O,二者反应的物质的量的比是1:1,若所得混合溶液的pH=10,说明碱过量,反应后溶液中c(OH-)=10-4mol/L则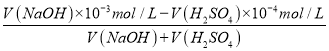 =10-4mol/L,解得V(NaOH):V(H2SO4)=2:9;
=10-4mol/L,解得V(NaOH):V(H2SO4)=2:9;
(4)95℃时,水的离子积为:c(H+)c(OH-)=10-12,在该温度下,pH=2的某HA溶液中c(H+)=10-2mol/L,pH=10的NaOH溶液中c(OH-)=10-2mol/L,两种溶液中c(H+)=c(OH-)=10-2mol/L,当二者等体积混合后,酸电离产生的H+恰好被中和,而混合溶液的pH=5,溶液显酸性,说明反应后酸过量,溶液中存在未电离的电解质分子又发生了电离作用,证明HA为弱酸,电离的HA和NaOH中和后,混合溶液中还剩余较多的HA分子,可继续电离出H+,使溶液pH=5。


 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________
(2)试通过计算确定该钠块中钠元素的质量分数为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①④B.①②C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察![]() Cl-粒子,完成下列问题:
Cl-粒子,完成下列问题:
(1)所含质子数________,中子数________,电子数________,质量数________。
(2)该元素的最高正化合价是________。
(3)该粒子的结构示意图________________,电子式________________。
(4)该粒子与![]() Cl的半径大小的关系是________________。
Cl的半径大小的关系是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是

A.反应前2min的平均速率v(Z)<2.0×103mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)>0.24mol·L-1
D.该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,属于弱电解质的是(填序号,下同)______,属于非电解质是_____。
①硫酸氢钠固体 ②冰醋酸 ③蔗糖 ④氯化氢气体 ⑤硫酸钡 ⑥氨气 ⑦次氯酸钠
(2)写出下列物质在水中的电离方程式:醋酸:______。次氯酸钠:______。
(3)甲、乙两瓶氨水的浓度分别为1 molL-1、0.1 molL-1,则c(OH﹣)甲:c(OH﹣)乙________ 10(填“大于”、“等于”或“小于”)。
(4)现有常温条件下甲、乙、丙三种溶液,甲为0.1 molL-1的NaOH溶液,乙为0.1 molL-1的HCl溶液,丙为0.1 molL-1的CH3COOH溶液,甲、乙、丙三种溶液中由水电离出的c(OH﹣)的大小关系为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 化合物X与Y中手性碳原子数目比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】试管实验操作简单,现象明显。以下试管实验操作及现象均正确的是( )
![]()
A. 直接向淀粉水解液中滴加新制氢氧化铜悬浊液,加热,产生砖红色沉淀
B. 向苯中滴加少量溴的四氯化碳溶液,充分振荡后静置,分层,上层无色,下层橙红色
C. 向FeSO4 溶液中滴加 K3[Fe(CN)6]溶液,振荡,溶液变血红色
D. 用一束强光照射鸡蛋白溶液,产生一条光亮的通路
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com