
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②保持体积不变,充入N2使体系压强增大
③将容器的体积缩小一半 ④保持压强不变,充入N2使容器体积变大
A.①④B.①②C.②③D.②④
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(Fe3+)的溶液中:K+、ClO-、SO42-、SCN-
B.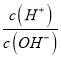 =1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
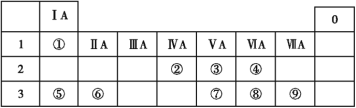
请按要求回答下列问题。
(1)元素③的名称是__,元素⑨的元素符号是____,元素④形成的单质具有____(填“氧化性”或“还原性”)。
(2)元素⑦⑧⑨的气态氢化物的稳定性由弱到强的顺序:____(用化学式表示)。
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:_____。
(4)写出元素⑤形成的单质与水反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
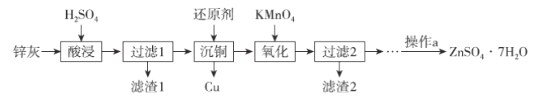
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火力发电厂释放出大量氮氧化物(NOx)、二氧化硫等气体会造成环境污染,对燃煤废气进行脱除处理.可实现绿色环保、低碳减排、废物利用等目的。
(1)脱硝。利用甲烷催化还原NOx:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ/mol CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2=-1160 kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为______。
(2)脱碳。
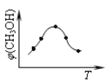
将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H3
CH3OH(g)+H2O(g)△H3
①取五份等体积CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线(见如图),则上述CO2转化为甲醇反应的△H3______0(填“>”、“<”或“=”)。
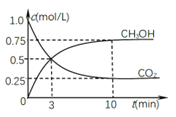
②在一恒温恒容密闭容器中充入0.5molCO2和1.5molH2,进行上述反应.测得CO2和CH3OH(g)的浓度随时间变化如图所示。请回答:0~10min内,氢气的平均反应速率_____;第10min后,若升温,将使c(CH3OH)/c(CO2)_____(填“变大”、“减小”、“不变”);判断理由是_________;若向该容器中再充入1molCO2和3molH2,再次达到平衡时,则CH3OH(g)的体积分数将_________(“变大”、“减小”、“不变”)。
(3)脱硫。某种脱硫工艺中将废气经处理后,与一定量的氨气、空气反应,生成硫酸铵和硝酸铵的混合物作为副产品化肥。设烟气中的SO2、NO2的物质的量之比为1:1,则该反应的化学方程式为___________。若在0.1mol/L的硝酸铵溶液中加入等体积的0.09mol/L氨水,配制了pH=8.2的溶液,则该溶液中微粒浓度由小到大的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A.加水,平衡向逆反应方向移动
B.滴加少量0.1mol/L HCl溶液,溶液中c(H+ )减少
C.加入少量CH3COONa固体,平衡向正反应方向移动
D.加入少量NaOH固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
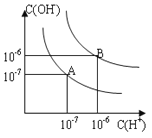
(1)则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______________。
(2)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______。
(3)25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔物理学奖曾授予“光纤之父”英国华裔科学家高锟以及两位美国科学家威拉德·博伊尔和乔治·史密斯。光导纤维的主要成分是二氧化硅,下列关于二氧化硅的说法正确的是( )
A.二氧化硅是酸性氧化物,因此能与水反应生成硅酸
B.用二氧化硅制取单质硅时,当生成2.24L气体(标准状况)时,得到2.8g硅
C.6g的二氧化硅中含有0.2mol的共价键
D.二氧化硅不能与碳酸钠溶液反应,但能与碳酸钠固体在高温时发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.30g乙酸和葡萄糖混合物中的氢原子数为2NA
B.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2 NA
C.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12 NA
D.标准状况下,2.24LC2H6含有的共价键数为0.6 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com