
【题目】在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________
(2)试通过计算确定该钠块中钠元素的质量分数为_________
【答案】Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑ 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑ 89%
【解析】
(1)根据题给信息可知:存在三个反应方程式:Na2O+H2O = 2NaOH, 2Na+2H2O = 2NaOH+H2↑,2Al+2NaOH+2H2O = 2NaAlO2+3H2↑;
答案是:Na2O+H2O = 2NaOH,2Na+2H2O = 2NaOH+H2↑, 2Al+2NaOH+2H2O = 2NaAlO2+3H2↑;
(2)n(NaOH) 余=2.0L×0.05 mol·L-1=0.1mol,n(H2)=![]() =0.05 mol,n(Al) =
=0.05 mol,n(Al) =![]() = 0.01mol,由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol =2×0.05mol,得:n(Na) =0.07 mol;根据Al守恒,n(NaAlO2)=n(Al)=0.01mol;由钠守恒知:n(NaAlO2)+n(NaOH) =n(Na)+2n(Na2O),即:0.01 mol+0.1 mol =0.07mol+2n(Na2O),得:n(Na2O) =0.02 mol;ω(Na元素) =
= 0.01mol,由电子守恒知:n(Na)+3n(Al) = 2n(H2),即:n(Na)+3×0.01 mol =2×0.05mol,得:n(Na) =0.07 mol;根据Al守恒,n(NaAlO2)=n(Al)=0.01mol;由钠守恒知:n(NaAlO2)+n(NaOH) =n(Na)+2n(Na2O),即:0.01 mol+0.1 mol =0.07mol+2n(Na2O),得:n(Na2O) =0.02 mol;ω(Na元素) =![]() ×100%≈89%;
×100%≈89%;
答案是:89%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】请按要求填空做答。
(1)NaHCO3能用于治疗胃酸过多,反应的离子方程式为_______。
(2)铁和水蒸气反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2,该反应中84g Fe参加反应,转移电子的物质的量为__________。
Fe3O4+4H2,该反应中84g Fe参加反应,转移电子的物质的量为__________。
(3)制备Fe(OH)3的实验操作:向煮沸的蒸馏水中加入几滴FeCl3溶液,______。
(4)密度为1.84g/cm3,质量分数为98%的浓硫酸的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对SCN-的性质进行探究,设计了以下实验
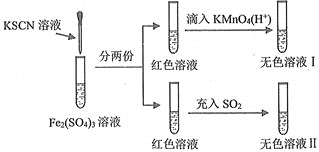
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(Fe3+)的溶液中:K+、ClO-、SO42-、SCN-
B.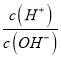 =1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是( )
A.1mol该有机物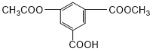 与NaOH溶液反应消耗氢氧化钠3mol
与NaOH溶液反应消耗氢氧化钠3mol
B.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有3种
C.某中性有机物C8H16O2在稀硫酸的作用下加热得到X和Y两种有机物,Y经氧化可最终得到X,则该中性有机物的结构可能有4种
D.已知![]() ,那么要生成
,那么要生成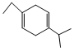 ,原料可以是1-丁炔和2-异丙基-1.3-丁二烯
,原料可以是1-丁炔和2-异丙基-1.3-丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
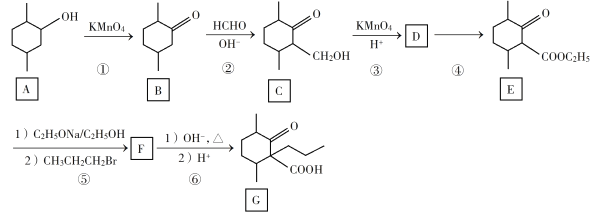
回答下列问题:
(1)C中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中,用星号(*)标出B中的手性碳_____________________。
(3)写出具有六元环结构、且环上只有1个取代基,并能与NaOH溶液发生反应的C的同分异构体的结构简式______________。(不考虑立体异构,只需写出2个)
(4)反应④所需的试剂和条件是____________________。
(5)②、⑤的反应类型是____________________。
(6)写出F到G的反应方程式_____________ 、_______________。
(7)乙酸苯甲酯(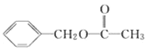 )是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
)是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A. 升高温度,正反应速率增大,逆反应速率减小
B. 若正反应是放热反应,则A为气态
C. 物质A一定为非气态,且正反应是吸热反应
D. 若向容器中充入惰性气体,则平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置:
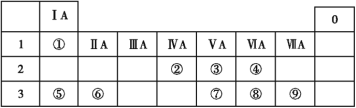
请按要求回答下列问题。
(1)元素③的名称是__,元素⑨的元素符号是____,元素④形成的单质具有____(填“氧化性”或“还原性”)。
(2)元素⑦⑧⑨的气态氢化物的稳定性由弱到强的顺序:____(用化学式表示)。
(3)写出一条能说明元素⑤的金属性比元素⑥强的事实:_____。
(4)写出元素⑤形成的单质与水反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如右图所示:
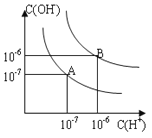
(1)则25℃时水的电离平衡曲线应为______(填“A”或“B”),请说明理由______________。
(2)95℃时,若10体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_______。
(3)25℃时,将pH=11的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=10,则NaOH溶液与H2SO4溶液的体积比为__________________。
(4)曲线B对应温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH = 5。请分析其原因:________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com