
【题目】下列有关叙述正确的是( )
A.1mol该有机物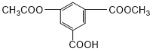 与NaOH溶液反应消耗氢氧化钠3mol
与NaOH溶液反应消耗氢氧化钠3mol
B.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生反应,一段时间后,分子中含有18O的物质有3种
C.某中性有机物C8H16O2在稀硫酸的作用下加热得到X和Y两种有机物,Y经氧化可最终得到X,则该中性有机物的结构可能有4种
D.已知![]() ,那么要生成
,那么要生成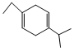 ,原料可以是1-丁炔和2-异丙基-1.3-丁二烯
,原料可以是1-丁炔和2-异丙基-1.3-丁二烯
【答案】BD
【解析】
A.羧基和酯基均能与NaOH反应,其中羧酸苯酯水解生成的酚也能和NaOH反应,则1mol该有机物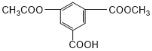 与NaOH溶液反应消耗氢氧化钠4mol,故A错误;
与NaOH溶液反应消耗氢氧化钠4mol,故A错误;
B.若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应的化学方程式为:CH3C18O18OH+H16OCH2CH3![]() CH3C18O16OCH2CH3+H218O,根据反应可知,酯化反应是可逆反应,所以含有18O的物质有:CH3C18O18OH、CH3C18O16OCH2CH3、H218O三种物质,故B正确;
CH3C18O16OCH2CH3+H218O,根据反应可知,酯化反应是可逆反应,所以含有18O的物质有:CH3C18O18OH、CH3C18O16OCH2CH3、H218O三种物质,故B正确;
C.中性有机物C8H16O2在稀硫酸作用下可生成两种物质,可见该中性有机物为酯类。由“Y经氧化最终可得到X”,说明X与Y中碳原子数相等,碳架结构相同,且Y应为羟基在碳链端位的醇,X则为羧酸,故Y为CH3CH2CH2CH2OH或(CH3)2CHCH2OH,对应的X为CH3CH2CH2COOH或(CH3)2CHCOOH,从而推知该中性有机物的结构只有![]() 和
和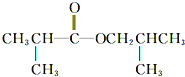 两种,故C错误;
两种,故C错误;
D.已知![]() ,则1-丁炔和2-异丙基-1.3-丁二烯可发生加成反应生成
,则1-丁炔和2-异丙基-1.3-丁二烯可发生加成反应生成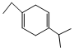 ,故D正确;
,故D正确;
故答案为BD。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】工业废气H2S经资源化利用后可回收能量并得到单.质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列有关说法不正确的是( )

A. 电极a为电池的负极
B. 电极b上的电极反应式为:O2+4H++4e-=2H2O
C. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
D. 若电路中通过2mol电子,则电池内部释放632kJ热能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0 mol L-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0 L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法不正确的是
A. 原固体混合物中,Cu和Mg的物质的量之比为2:1
B. 氢氧化钠溶液的浓度为0.8 mol·L-1
C. 固体溶解后的溶液中硝酸的物质的量为0.1mol
D. 生成的NO气体在标况下的体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项与化学平衡移动原理无关的是( )。
A.加催化剂,使N2和H2在一定的条件下转化为NH3
B.收集氯气用排饱和食盐水的方法
C.加压条件下有利于SO2和O2反应生成SO3
D.可用浓氨水和氢氧化钠固体快速制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-= AlO2-+H2↑
B.过量铁粉与一定量稀硝酸反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
C.澄清石灰水中加入过量NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
D.向苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050 mol·L-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式:_____________ _____________ _____________
(2)试通过计算确定该钠块中钠元素的质量分数为_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
A. NH3![]() NO2
NO2![]() HNO3B. Al
HNO3B. Al![]() NaAlO2(aq)
NaAlO2(aq)![]() NaAlO2(s)
NaAlO2(s)
C. Fe![]() Fe2O3
Fe2O3![]() FeD. AgNO3(aq)
FeD. AgNO3(aq)![]() [Ag(NH3)2OH(aq)]
[Ag(NH3)2OH(aq)]![]() Ag
Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.被誉为改变未来世界的十大新科技之一的燃料电池。 右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.

试回答下列问题:
(1)燃料电池的优点是________;电解质溶液中的OH-移向______极(填“负”或“正”).
(2)写出氢氧燃料电池工作时正极反应式:_______________________。
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________.
(4)利用该装置可以处理氮的氧化物和NH3 尾气,总反应为:6NO2 +8NH3=7N2+12H2O,负极反应式为__________。
II.将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为80 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为41g,试计算:
(1)产生氢气的体积(标准状况)为________________;
(2)通过导线的电子数为__________(用NA表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察![]() Cl-粒子,完成下列问题:
Cl-粒子,完成下列问题:
(1)所含质子数________,中子数________,电子数________,质量数________。
(2)该元素的最高正化合价是________。
(3)该粒子的结构示意图________________,电子式________________。
(4)该粒子与![]() Cl的半径大小的关系是________________。
Cl的半径大小的关系是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com