
【题目】合成氨是人类科学技术发展史上的一项重大突破,解决了地球上因粮食不足导致的饥饿和死亡问题,这也充分说明了含氮化合物对人类生存的巨大意义。回答下列问题
(1)工业上用氢气和氮气直接合成氨,写出反应的化学方程式_______________。氨气极易溶于水,水溶液显 _____性,能使酚酞溶液变____色,使湿润的红色石蕊试纸变_____色。
(2)氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与空气变___色,原因是__________(用化学方程式表示);二氧化氮易溶于水并与水反应,此反应的氧化剂是_______,还原剂是______,氧化剂和还原剂的质量之比为______
【答案】N2+3H2![]() 2NH3 碱 红 蓝 红棕色 2NO+O2==2NO2 NO2 NO2 1:2
2NH3 碱 红 蓝 红棕色 2NO+O2==2NO2 NO2 NO2 1:2
【解析】
(1)工业上用氢气和氮气直接合成氨,反应的化学方程式为N2+3H2![]() 2NH3;氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,使湿润的红色石蕊试纸变蓝色;
2NH3;氨气极易溶于水,水溶液显碱性,能使酚酞溶液变红色,使湿润的红色石蕊试纸变蓝色;
(2)氮的氧化物有多种,一氧化氮和二氧化氮都是大气污染物。氨气在催化剂作用下可被氧化生成一氧化氮,一氧化氮气体与遇空气变红棕色,原因是2NO+O2==2NO2;二氧化氮易溶于水并与水反应,此反应中氮元素由+4价变为+2价,故氧化剂是NO2,氮元素也从+4价变为+5价,故还原剂是NO2,氧化剂和还原剂的质量之比为1:2。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
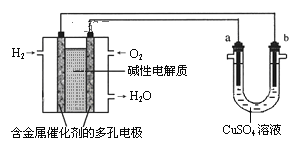
A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知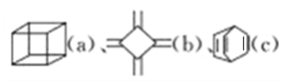 的分子式均为C8H8,下列说法正确的是( )
的分子式均为C8H8,下列说法正确的是( )
A.c可与酸性高锰酸钾溶液反应,a和b不行
B.a、b 的二氯代物均有3种,c的二氯代物有6种
C.a的同分异构体中除b、c外,还可以是苯的同系物
D.a、b、c中只有b、c的所有原子处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对SCN-的性质进行探究,设计了以下实验
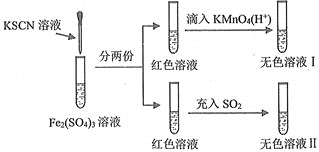
已知:(CN)2、(SCN)2、(OCN)2等称之为拟卤素,它们的化学性质均与卤素单质相似。下列说法正确的是( )
A.溶液颜色变红时发生反应的离子方程式是:Fe3++3SCN-=Fe(SCN)3↓
B.红色溶液褪色表现了SO2的漂白性
C.氧化性:KMnO4>Fe3+>(SCN)2
D.无色溶液Ⅱ中滴入适量的KMnO4(H+)溶液,溶液又变成红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科罗拉多大学的克利斯托(S.Cristol)等人合成了一种有机分子,这种分子让他想起罗马的两面神Janus—罗马的守门神,克利斯托的同事迈金泰(Macintyre)就建议将该分子叫做Janusene。该有机物的结构简式如图所示:
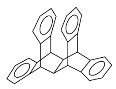
下列说法正确的是( )
A.该有机物属于苯的同系物
B.该有机物完全燃烧生成CO2和H2O的物质的量之比为15∶11
C.该有机物的一氯代物只有4种
D.该有机物只能发生取代反应而不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.c(Fe3+)的溶液中:K+、ClO-、SO42-、SCN-
B.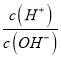 =1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
=1×1012的溶液中:NH4+、Al3+、NO3-、Cl-
C.由水电离产生的c(OH-)=1×10-13mol/L的溶液中:Ca2+、K+、Cl-、HCO3-
D.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是一种药物合成中间体,其合成路线如下:
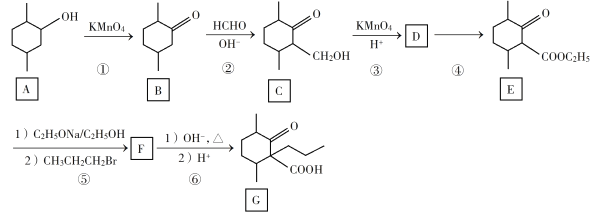
回答下列问题:
(1)C中的官能团名称是________________。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。在B的结构简式中,用星号(*)标出B中的手性碳_____________________。
(3)写出具有六元环结构、且环上只有1个取代基,并能与NaOH溶液发生反应的C的同分异构体的结构简式______________。(不考虑立体异构,只需写出2个)
(4)反应④所需的试剂和条件是____________________。
(5)②、⑤的反应类型是____________________。
(6)写出F到G的反应方程式_____________ 、_______________。
(7)乙酸苯甲酯(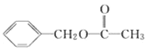 )是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
)是一种常用香料,设计以甲苯和乙酸为原料制备乙酸苯甲酯的合成路线:__________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌是制造锌钡白和锌盐的主要原料,也可用于湿法电解制锌,如图为由锌灰制ZnSO4·7H2O晶体的工艺流程:
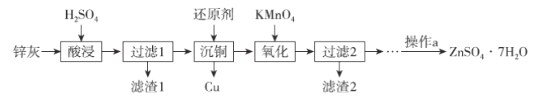
已知:①锌灰的主要成分为ZnO,还含有CuO、PbO、MnO和FeO;
②“滤渣2”的主要成分为Fe(OH)3和MnO(OH)2。
请回答下列问题:
(1)MnO(OH)2中Mn元素的化合价为_____________。
(2)“滤渣1”的主要成分为_____________。
(3)“氧化”时,需控制溶液的pH=5.1,Fe2+被氧化的离子方程式为_____________。
(4)操作a为_________、过滤、洗涤、干燥。
(5)ZnSO4·7H2O产品的纯度可用配位滴定法测定。准确称取一定量的ZnSO4·7H2O晶体加入250 mL的锥形瓶中,加水约20 mL,再加入2~3滴5%的二甲酚橙作指示剂、约5 mL六亚甲基四胺缓冲溶液,摇匀。用已标定的0.0160 mol/LEDTA溶液滴定,滴定至溶液由红紫色变成亮黄色,即为终点(ZnSO4·7H2O与EDTA按物质的量之比1:1反应)。实验数据如下表:
m(ZnSO4·7H2O)/g | 起始滴定管读数/mL | 终点滴定管读数/mL |
0.1692 | 0.20 | 26.50 |
ZnSO4·7H2O产品的纯度为_____________(保留2位有效数字)。
(6)工业上采用惰性电极作阳极电解ZnSO4溶液可实现湿法炼锌,电解过程中的离子方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com