
草酸是二元中强酸,草酸氢钠溶液显酸性。常温下,向10 mL 0.01 mol/LNaHC2O4溶液中滴加0.01 mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是
| A.V(NaOH)=0时,c(H+)=1×10-2mol/L |
| B.V(NaOH)<10mL时,不可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) |
| C.V(NaOH)=10mL时,c(H+)=1×10-7mol/L |
| D.V(NaOH)>10mL时,c(Na+)>c(C2O42-)>c(HC2O4-) |
D
解析试题分析:A、草酸是二元中强酸,V(NaOH)=0时,NaHC2O4不能完全电离出H+,则c(H+)<1×10-2mol?L-1,故A错误;B、V(NaOH)<10mL时,溶液中溶质为NaHC2O4、Na2C2O4,当电离程度等于水解程度,即c(H+)=c(OH-),存在c(Na+)=2c(C2O42-)+c(HC2O4- ),故B不正确;C、V(NaOH)=10 mL时,溶液中溶质为Na2C2O4,溶液显碱性,则c(H+)<1×10-7mol?L-1,故C错误;D、V(NaOH)>10 mL时,溶液中溶质为NaOH、Na2C2O4,C2O42-水解生成HC2O4-,则离子浓度为c(Na+)>c(C2O42-)>c(HC2O4- ),故D正确;故选D。
考点:考查盐类水解、电离平衡以及溶液中离子浓度大小比较


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
25 ℃时,2a mol·L-1次氯酸水溶液中,用NaOH溶液调节其pH(忽略溶液体积的变化),得到c(HClO)、c(ClO-)与溶液pH的变化关系如图所示。下列说法正确的是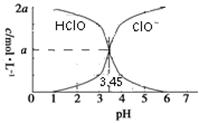
| A.当pH=2时,溶液中c(ClO-)>c(Na+) |
| B.当c(ClO-)>c(HClO)时,溶液一定呈碱性 |
| C.当pH=3.45时,所加NaOH溶液恰好与HClO完全反应 |
| D.当pH=5时,溶液中:c(HClO)+c(Na+)+c(H+)-c(OH-)=2a mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是
A.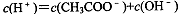 |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表: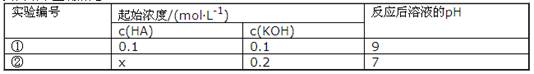
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后溶液中:c(OH-)=c(K+)-c(A-)=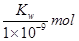 ·L-1
·L-1
C.实验②反应后的溶液中:c(A-)+c(HA)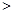 0.1mol·L-l
0.1mol·L-l
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知H2A为弱酸,下列说法错误的是
A.0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+ c(H2A)= 0.1mol/L
B.常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5
C.常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性
D.常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥pH=4、浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
| A.①②④ | B.①③⑤ | C.③⑤⑥ | D.②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混台后所得溶液
的pH如下表: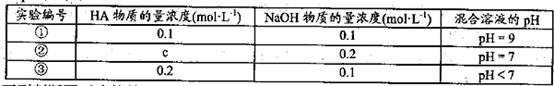
下列判断不正确的是
A.HA的电离方程式为: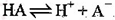 |
B.不考虑其他组的实验结果,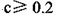 |
C.③组实验中,混合溶液中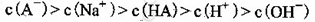 |
D.①组实验中,混合溶液中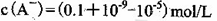 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.两种难溶物中溶解度小的物质其KSP不一定小 |
| B.同种酸形成的酸式盐溶解度一定比正盐的溶解度大 |
| C.因为Ksp(BaSO4)= 1.08×l0-l0,Ksp(BaCO3)=8.1×10-9,所以BaSO4沉淀不可能转化为BaCO3沉淀 |
| D.相同温度下,将足量AgCl固体分别加入同体积的①0.1mo1·L-l盐酸、②0.1mo1·L-1氯化镁溶液、③0.1mo1·L-l l硝酸银溶液中,c(Ag+):③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列选项合理的是 ( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com