
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .
【答案】
(1)30;10;17.5;灰黑;紫红;当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积
(2)不;浓度增大的倍数和压强增大的倍数相同;正向;加压至1000kPa时,C物质变成了非气态物质
【解析】解:(1)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.所以答案是:30;10;17.5;②A中没有加入硫酸铜,锌与稀硫酸反应后,锌的表面凹凸不平,有很多细小的锌的颗粒,由于颗粒很小,光被完全吸收,所以看到的固体是灰黑色;Zn能够置换出Cu附着在Zn表面,金属变为紫红色,所以答案是:灰黑;紫红;③因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
所以答案是:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.(2)①根据表中数据,压强从 200kPa增加到500kPa,增大了2.5倍,B的浓度从0.04mol/L增大到0.1mol/L,也增大了2.5倍,说明浓度增大的倍数和压强增大的倍数相同,化学计量数满足a=b+c,改变压强化学平衡不移动,所以答案是:不;浓度增大的倍数和压强增大的倍数相同;②利用表中数据可知,压强增大的倍数为1000kPa/500kPa=2,B的浓度增大的倍数为0.27mol/L/0.1mol/L=2.7,浓度增大的倍数大于压强增大的倍数,说明加压至1000kPa时,C物质变成了非气态物质,所以增大压强化学平衡向“正向”移动,所以答案是:正向;加压至1000kPa时,C物质变成了非气态物质.


科目:高中化学 来源: 题型:
【题目】白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示.下列叙述中正确的是( ) 
A.黑磷比白磷稳定
B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL﹣1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL﹣1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是 .
②II中发生了分解反应,反应的化学方程式是 .
③III中无明显现象的原因,可能是c(H+)或c(Cl﹣)较低,设计实验(图1)IV进行探究: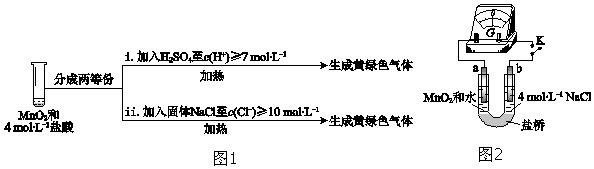
将实验 III、IV作对比,得出的结论是;将 i、ii作对比,得出的结论是 .
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL﹣1 , 指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是 .
(2)研究盐酸能否被氧化性酸氧化. ①烧瓶中放入浓H2SO4 , 通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3 , 试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2 .
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验 I、II、III证明混合气体中含有Cl2 , III的操作是 .
由上述实验得出:盐酸能否被氧化与氧化剂的种类、有关.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁过程中发生的主要反应为 ![]() Fe2O3(s)+CO(g)=
Fe2O3(s)+CO(g)= ![]() Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
Fe(s)+CO2(g)已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K= , △H0(填“>”、“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)=、CO的平衡转化率=:
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 .
A.减少Fe的量
B.增加Fe203的量
C.移出部分CO2
D.提高反应温度
E.减小容器的容积
F.加入合适的催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用右图所示装置制备乙酸乙酯。实验如下:( )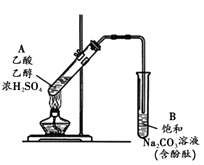
① 向浓H2SO4乙醇混合液中滴入乙酸后,加热试管A
② 一段时间后,试管B中红色溶液上方出现油状液体
③ 停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色
④ 取下层褪色后的溶液,滴入酚酞后又出现红色
结合上述实验,下列说法正确的是
A.①中加热利于加快酯化反应速率,故温度越高越好
B.③中油状液体层变薄主要是乙酸乙酯溶于Na2CO3溶液所致
C.③中红色褪去的原因可能是酚酞溶于乙酸乙酯中
D.取②中上层油状液体测其,共有3组峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能可与热能、电能等相互转化。下列表述不正确的是( )
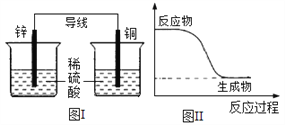
A. 有能量变化是化学反应的基本特征之一
B. 图I所示的装置能将化学能转变为电能
C. 图II所示的反应为放热反应
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某学生的化学实验中有如下记录,其中能达到测量要求的是( )
A. 用托盘天平称取35.20 g NaCl B. 用10 mL量筒量取8.5 mL盐酸
C. 用50 mL 烧杯量取15.80 mL溶液 D. 用250 mL 容量瓶量取25 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( ) 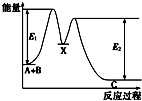
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列检验铵盐的方法中,正确的是
A.加入氢氧化钠溶液,加热试管,再滴入酚酞试液
B.加入氢氧化钠溶液,加热试管,并用湿润的红色石蕊试纸接近试管口上方
C.加热试管,并用湿润的红色石蕊试纸接近试管口上方
D.加水溶解,再用红色石蕊试纸检验其溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com