
【题目】化学能可与热能、电能等相互转化。下列表述不正确的是( )
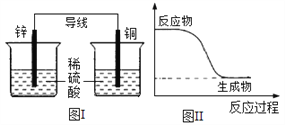
A. 有能量变化是化学反应的基本特征之一
B. 图I所示的装置能将化学能转变为电能
C. 图II所示的反应为放热反应
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)2C(g)+D(g),经2min B的浓度减少0.6molL﹣1 . 对此反应速率的正确表示是( )
A.用A表示的反应速率是0.8 molL﹣1s﹣1
B.分别用B,C,D表示反应的速率,其比值是3:2:1
C.在2 min末时的反应速率,用反应物B来表示是0.3 molL﹣1min﹣1
D.在这2 min内用B和C表示的反应速率的值都是相同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究并回答问题
(1)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| A | B | C | D | E | F |
4molL﹣1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= , V6= , V9=;
②反应一段时间后,实验A中的金属呈色,实验E中的金属呈色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因 .
(2)在100℃和200kPa的条件下,反应aA(g)bB(g)+cC(g)建立平衡后,在不加入任何物质的条件下逐步增大体系的压强(维持温度不变),下表列出的不同压强下反应建立平衡时物质B的浓度.
压强(kPa) | 200 | 500 | 1 000 |
B的浓度(molL﹣1) | 0.04 | 0.1 | 0.27 |
根据表中的数据,回答下列问题:
①压强从200kPa增加到500kPa时,平衡移动(填“正向”“逆向”或“不”),理由是 .
②压强从500kPa增加到1 000kPa时,平衡转移(填“正向”“逆向”或“不”),其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,元素①~⑨在周期表中的位置如图所示(序号代表对应的元素)。
① | |||||||||||||||||
② | ③ | ④ | ⑤ | ||||||||||||||
⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||||
…… | |||||||||||||||||
(1)④在周期表中位于第_____周期_____族。
(2)9种元素中原子半径最大的是______(填元素符号),非金属性最强的是______(填元素符号);
(3)最高价氧化物对应水化物的碱性⑥_____⑦(填“>”或“<”)。
(4)⑧的阴离子的结构示意图为______;③的简单氢化物与⑧的最高价氧化物对应水化物化合生成的盐的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈 的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法不正确的是( )
A.X的化学式为Ag2S
B.银针验毒时,空气中氧气得到电子
C.反应中Ag和H2S均是还原剂
D.每生成1molX,反应转移2mol e﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
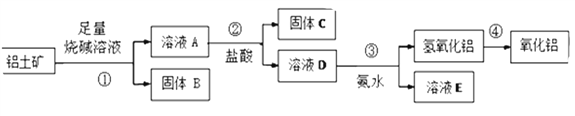
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有浓度均为0.1molL﹣1的盐酸、硫酸和醋酸三种溶液,试分析:
(1)若溶液的C(H+)分别为a、b、c,则它们的大小关系是(用“>”“<”“=”表示),
(2)分别用三种酸中和等物质的量的氢氧化钠溶液,所需溶液的体积分别是a、b、c,则它们的大小关系是(用“>”“<”“=”表示).
(3)等体积的三种酸分别与足量的锌粒反应,在相同条件下若产生气体的体积分别为a、b、c,则它们的关系是 .
(4)可逆反应2Cl2(g)+2H2O(g)4HCl(g)+O2(g)△H>0,在一定条件下达到平衡后,分别采取下列措施(填“增大”、“减小”或“不变”):
①降低温度,Cl2的转化率;
②保持容器体积不变,加入He,则HCl的物质的量;
③保持容器压强不变,加入He,则O2的体积分数 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com