
【题目】某课外小组研究铝土矿中Al2O3的含量。查阅资料得知,铝土矿的主要成分是Al2O3,杂质是Fe2O3、SiO2等。从铝土矿中提取Al2O3的过程如下:
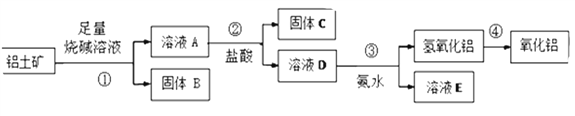
(1)固体B的主要用途有(写出1条即可)__________________________ 。
(2)第①步,向铝土矿中加入足量烧碱溶液后,发生反应的离子方程式是:_____________________________________________________________;___________________________________________________________。
(3)第③步中,生成氢氧化铝的离子方程式是____________________________________________________________。
(4)工业上制取AlCl3用Al2O3与C、Cl2在高温条件下反应,每消耗0.5 mol碳单质,转移1 mol电子,反应的化学方程式是___________________________________________________。
(5)将实验过程中所得固体精确称量。课外小组发现所得氢氧化铝固体的质量与原铝土矿质量相等,则该铝土矿中Al2O3的质量分数是________。(保留一位小数)
【答案】 炼铁原料、油漆等 Al2O3+2OH—=2AlO2—+H2O SiO2+2OH—=SiO32—+H2O Al3++3NH3·H2O=Al(OH)3↓+3NH4+ Al2O3+3Cl2+3C![]() 2AlCl3+3CO 65.4%
2AlCl3+3CO 65.4%
【解析】试题分析:(1)Al2O3、Fe2O3、SiO2中只有氧化铁和氢氧化钠不反应,所以固体B为Fe2O3,主要用途为炼铁、油漆等;(2)Al2O3、Fe2O3、SiO2中Al2O3、SiO2和氢氧化钠反应,方程式分别为:Al2O3+2OH-=2AlO2-+H2O、 SiO2+2OH-= SiO32-+ H2O;(3)溶液D的成分为氯化铝,与氨水反应的方程式为Al3++3NH3·H2O=Al(OH)3↓+ 3NH4+;(4) 每消耗0.5 mol碳单质,转移1 mol电子,说明碳被氧化为一氧化碳,反应方程式为Al2O3+3Cl2+3C![]() 2AlCl3+3CO;(5)根据铝元素守恒,设氧化铝的物质的量为xmol,则生成氢氧化铝的物质的量为2x mol,所以该铝土矿中Al2O3的质量分数是
2AlCl3+3CO;(5)根据铝元素守恒,设氧化铝的物质的量为xmol,则生成氢氧化铝的物质的量为2x mol,所以该铝土矿中Al2O3的质量分数是![]() 。
。


科目:高中化学 来源: 题型:
【题目】取100 mL 0.3 mol/L和300 mL 0.25 mol/L的硫酸注入500 mL容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是 ( )
A. 0.21 mol/L B. 0.42 mol/L C. 0.56 mol/L D. 0.26 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能可与热能、电能等相互转化。下列表述不正确的是( )
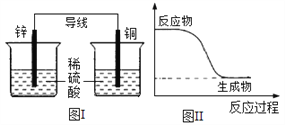
A. 有能量变化是化学反应的基本特征之一
B. 图I所示的装置能将化学能转变为电能
C. 图II所示的反应为放热反应
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出)。
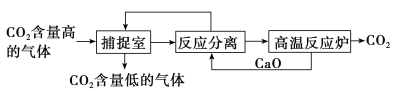
下列有关该方法的叙述中正确的是
①能耗大是该方法的一大缺点
②“反应分离”环节中,分离物质的基本操作是蒸发结晶、过滤
③该方法可减少碳排放,捕捉到的CO2还可用来制备干冰等产品
④整个过程中,只有一种物质可以循环利用
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E4表示反应A+B→X的活化能,下列有关叙述正确的是( ) 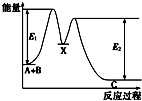
A.Ee表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的△H<0
D.加入催化剂可改变反应A+B→C的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氮的固定的是
①N2和H2在一定条件下反应生成NH3
②雷雨闪电时空气中的N2和O2化合生成NO
③NH3经过催化氧化生成NO
④NH3和HNO3反应生成NH4NO3
A.①③B.②④C.③④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列的可逆反应:A(g)+B(g)xC(g) , 有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 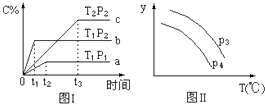
A.P3>P4 , y轴表示B的转化率
B.P3<P4 , y轴表示B的体积分数
C.P3<P4 , y轴表示混合气体的密度
D.P3<P4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.2NA
B. 标准状况下11.2L二氧化硫中含有的原于数为2NA
C. 标准状况下,22.4L氯气发生反应转移电子数一定为2NA
D. 0.1mol/LCuCl2溶液中Cl-数目是0.2NA
【答案】A
【解析】 A、因为Fe和盐酸反应氧化产物是Fe 2+ ,5.6 g铁失去电子数为0.2 N A,选项A错误;B、B. 标准状况下11.2L二氧化硫中含有的原子数为![]() 3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
3NA=3NA,选项B错误;C、1 mol 氯气参加反应时,氯气可以只做氧化剂,也可以自身氧化还原反应,电子转移数目可以为2NA或NA,选项C错误;D、溶液体积不明确,故溶液中的氯离子的个数无法计算,选项D错误。答案选A。
【题型】单选题
【结束】
23
【题目】实验室利用以下反应制取少量氨气:NaNO2+NH4Cl=NaC1+N2↑+2H2O,关于该反应的下列说法正确的是
A. NaNO2发生氧化反应
B. 每生成1molN2转移的电子的物质的量为3mol
C. NH4Cl中的氯元素被还原
D. N2既是氧化剂,又是还原剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com